
科目: 来源: 题型:

(1)所用试剂的名称:甲_____________、乙_____________、丙_____________。
(2)丙中现象_________________________________________________________。
丙中反应的化学方程式:________________________________________________。
(3)实验结论:_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
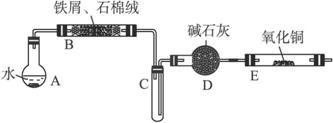
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,去掉Na2CO3溶液,然后将废铁屑用蒸馏水洗涤2—3遍,用滤纸吸干水分。
②将洗涤干燥后的废铁屑和石棉绒混合置于气密性良好的上述装置B中。
③先点燃X处的酒精灯,待试管C中出现大量水雾时,点燃Y处的酒精喷灯。
④经过必要的实验操作后,点燃Z处的酒精灯。
⑤停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。
⑥利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
液体![]() FeCl3溶液
FeCl3溶液![]() FeCl3·6H2O晶体
FeCl3·6H2O晶体
回答下列问题:
(1)实验步骤①的目的是________________________________________________________。
(2)步骤③X处是指___________(用图中的A、B、C……表示);待试管C中出现大量水雾时才点燃Y处的酒精喷灯,这样做的目的是:______________________________________。
(3)步骤④必要的实验操作是指:________________________________________________。
(4)步骤⑥从FeCl3溶液得到FeCl3·6H2O晶体的主要操作包括:______________________,这个过程中需保持盐酸过量,主要原因是___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
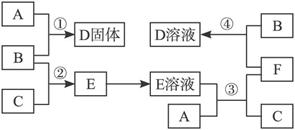
(1)单质A的晶体类型为_____________,B的化学式是_____________。
(2)反应③的化学方程式为_____________________________________。
(3)反应④的离子方程式为_____________________________________。
(4)D的水溶液滴入沸水中可得胶体,反应的化学方程式为_______________________;
该胶体具有的性质是_____________(填序号)。
a.光束通过该液体时形成光亮的“通路”
b.该液体中分散质粒子很小,可以透过半透膜
c.将该液体加热、蒸干、灼烧后,有氧化物生成
d.该液体分散质微粒具有较大的表面积,在电场作用下会产生电泳现象
查看答案和解析>>
科目: 来源: 题型:
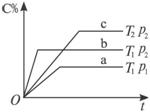
(1)①在50 s内,甲容器中O2的化学反应速率为_____________,甲容器达到平衡时SO2的转化率是_____________。
②乙容器达到平衡时所需时间_____________50 s(填“大于”“小于”或“等于”)。
(2)达到平衡状态后,要使甲、乙两容器中SO2物质的量相等,可采取的措施是_____________(填字母)。
A.保持温度不变,适当扩大甲容器的容积
B.保持容积不变,使乙容器升温
C.保持容积和温度不变,向乙容器中加入适量SO3(g)
D.保持容积和温度不变,向甲容器中加入适量SO3(g)
查看答案和解析>>
科目: 来源: 题型:
(1)D元素处于周期表的第____________族。
(2)B
(3)液态X类似B
(4)已知A、D、E三种元素可以形成化学式为A9D3E的盐。A9D3E的水溶液呈____________性,用离子方程式解释其原因:__________________________。
(5)W、Q分别由A、B、C、D四种元素中任意三种组成,是不同类型的强电解质。W的水溶液呈碱性,Q的水溶液呈酸性,且物质的量浓度相同的W、Q溶液中水的电离程度:前者小于后者。Q为____________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
A.![]() 原子中的中子和质子的个数比为2∶1
原子中的中子和质子的个数比为2∶1
B.在NaHCO3溶液中一定有:c(Na+)+c(H+)=c(![]() )+?c(
)+?c(![]() )+c(OH-)
)+c(OH-)
C.NaOH与CH3COOH混合液中,可能出现:c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
D.常温下,pH=2的盐酸和pH=12的Ba(OH)2溶液等体积混合,溶液pH一定等于7
查看答案和解析>>
科目: 来源: 题型:
A.20% B.40% C.60% D.80
查看答案和解析>>
科目: 来源: 题型:
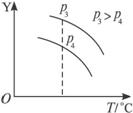
Ⅰ Ⅱ
A.A为气态,B一定为气态
B.上述可逆反应的正反应的ΔH>0
C.图(Ⅱ)中,Y轴表示A的转化率
D.图(Ⅱ)中,Y轴表示平衡混合气体中A的物质的量
查看答案和解析>>
科目: 来源: 题型:
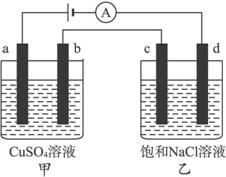
A.甲、乙两烧杯中溶液的pH均保持不s变
B.乙烧杯中d的电极反应为2Cl--2e-====Cl2↑
C.乙烧杯中通入适量HCl气体溶液组成可以恢复
D.a极产生
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com