
科目: 来源: 题型:

有关物质在水中溶解度分别为:
氯化铵:
请回答下列问题:
(1)上述流程中发生两步化学反应,第一步反应的化学方程式为________________________,第二步反应能进行是因为_____________________________________________________。
(2)操作Ⅰ需要用到的玻璃仪器除玻璃棒外,还有______________________________。
(3)操作Ⅱ的作用是___________________________________________________。
(4)操作Ⅲ的具体过程是________________________________________________。
(5)流程中NH4HCO3必须过量,其原因是_____________________________________。
查看答案和解析>>
科目: 来源: 题型:

(1)打开K1,关闭K2,可制取某些气体。
甲同学认为装置Ⅰ可用于制取H2、NH3、O2,但装置Ⅱ只能收集H2、NH3,不能收集O2。其理由是______________________________。
乙同学认为在不改动装置Ⅱ仪器的前提下,进行适当改进,也可收集O2。你认为他的改进方法是______________________________。
(2)打开K2,关闭K1,能比较一些物质的性质。
丙同学设计实验比较氧化性:KMnO4>Cl2>Br2。由A向B中加浓盐酸后一段时间,观察到C中的现象是_______________;仪器D在该装置中的作用是___________________________。
丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是__________________。
查看答案和解析>>
科目: 来源: 题型:


图Ⅰ:在条件Ⅰ时的反应情况 图Ⅱ:在条件Ⅱ时的反应情况
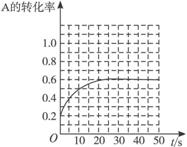
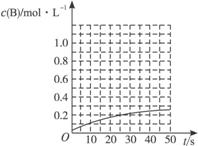
图Ⅲ:在条件Ⅲ时的反应情况 图Ⅳ:在条件Ⅳ时的反应情况
下列有关说法中正确的是
A.条件Ⅰ、条件Ⅱ时的反应温度不同,压强相同
B.条件Ⅰ时可能未使用催化剂,条件Ⅱ时可能使用了催化剂
C.条件Ⅲ时的平衡混合物中,物质C的浓度等于0.6 mol·L-1
D.条件Ⅳ和条件Ⅱ相比较,条件Ⅳ时可能增大了反应体系的压强
查看答案和解析>>
科目: 来源: 题型:

方英石结构
下列有关说法正确的是
A.方英石晶体中存在着SiO4结构单元
B.1 mol Si原子形成2 mol Si—O键
C.上图所示的结构单元中实际含有18个Si原子
D.方英石晶体中,Si—O键之间的夹角为90°
查看答案和解析>>
科目: 来源: 题型:

A.电极b为电池负极,电极反应式为O2+4e-====4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-====2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-====2CO2+2H2O
查看答案和解析>>
科目: 来源: 题型:
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(Ac-)>c(OH-)>c(H+)
C.浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol·L
查看答案和解析>>
科目: 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 |
| +2 | +1 | +5 | +7 | +1 | +5 | +3 |
-2 |
|
| -3 | -1 |
| -3 |
|
下列推断合理的是
A.元素②与元素③处于同一周期 B.元素④的原子序数大于元素⑦
C.元素⑧的还原性比元素⑥强 D.元素⑤最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目: 来源: 题型:

A.青霉氨基酸分子中所有碳原子均在同一直线上
B.青霉氨基酸具有两性并能发生酯化反应
C.青霉氨基酸分子间能形成多肽
D.1 mol青霉氨基酸与足量的金属钠反应生成0.5 mol H2
查看答案和解析>>
科目: 来源: 题型:
A.一定存在Fe2+、Br-、![]() B.一定呈碱性
B.一定呈碱性
C.一定不存在I-、![]() D.可能存在
D.可能存在![]()
查看答案和解析>>
科目: 来源: 题型:
A.常温常压下,22.4 L N2所含的分子数小于NA
B.在含有1 mol CH3COO-的醋酸钠溶液中,Na+数目略大于NA
C.
D.0.1 mol Fe与0.1 mol Cl2充分反应,转移的电子数为 0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com