
科目: 来源: 题型:
A.由于石灰与水产生的氢氧化钙显碱性,可以使病毒蛋白失去活性
B.饱和石灰水中加入生石灰,在温度不变的情况下,pH不变
C.饱和石灰水中加入生石灰,在温度不变的情况下,Ca2+的物质的量不变
D.给饱和石灰水溶液升高温度,c(OH-)的浓度降低
查看答案和解析>>
科目: 来源: 题型:
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等 ②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应 ③根据分散系是否具有丁达尔效应将分散系分为溶液、胶体和浊液 ④根据反应中的热效应将化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目: 来源: 题型:
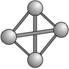
A.N4属于一种新型的化合物 B.N4沸点比P4(白磷)高
C.N4与N2互为同素异形体 D.1 mol N4气体转变为N2将吸收882 kJ热量
查看答案和解析>>
科目: 来源: 题型:
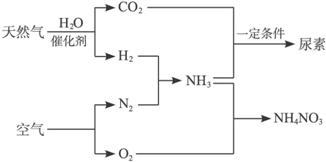
某工厂以标准状况下的含CH4 89.6%的天然气
(1)合成氨生产过程中氨的产率为60%,假设其他各步反应均完全且不考虑副反应,求
(2)为使硝酸生产过程中不再补充空气,假设各步反应均完全且氨中氮元素全部转化为HNO3,空气中氧气的体积分数设为20%,求由氨气和空气组成的原料气中(不包含被硝酸吸收的氨气)氨气与空气的体积比。
(3)实际生产中,若氨的产率为60%,硝酸的产率为80%,求
(注:产率=![]() ×100%)
×100%)
查看答案和解析>>
科目: 来源: 题型:
(1)配制0.010 mol·L-1标准硫酸亚铁铵溶液500 mL时,需称取硫酸亚铁铵晶体〔(NH4)2Fe(SO4)2·6H2O〕的质量为___________g。
(2)硫酸亚铁铵标准溶液在空气中放置后浓度会发生变化,需用重铬酸钾标准溶液标定硫酸亚铁铵溶液的实际浓度。现取0.004 0 mol·L-1重铬酸钾标准溶液10.00 mL,滴定时,用去25.00 mL硫酸亚铁铵溶液,则硫酸亚铁铵标准溶液的实际浓度为___________(K2Cr2O7的还原产物为Cr3+)。
(3)实际操作中,检测人员在标定标准硫酸亚铁铵溶液浓度时,每次取浓度值为c的重铬酸钾标准溶液10.0 mL,计算时只要测出滴定中消耗的标准硫酸亚铁铵溶液体积(V,单位 mL)就可以依据一个简单的计算式直接计算出标准硫酸亚铁铵溶液的实际浓度。该计算式为___________。
查看答案和解析>>
科目: 来源: 题型:
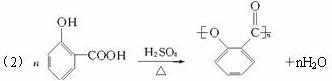
回答下列问题:
(1)在反应①—④中属取代反应的是_______________。
(2)写出反应④的化学方程式_______________________________________________。
(3)把阿司匹林分子连接在某高分子化合物上,便可形成结构如下的缓释长效药剂:
长效阿斯匹林完全水解后生成的有机物有__________种。
(4)甲苯也可用来合成水杨酸。请设计合理方案由甲苯合成水杨酸(用反应流程图表示,并注明反应条件)。
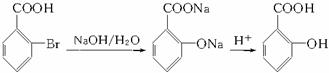 _____________________________________________________
_____________________________________________________
查看答案和解析>>
科目: 来源: 题型:
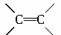
已知:![]()
R—CH=CH—R′![]() R—COOH+R′—COOH
R—COOH+R′—COOH
回答下列问题:
(1)写出Q的分子式:________________。
(2)上述转化过程中,发生氧化反应的官能团是________________________________。
(3)写出B→C的化学方程式_________________________________________________。
(4)D有多种同分异构体,其中分子中只含一种官能团、烃基上一元取代物只有一种的同分异构体的结构简式是________________(要求写两种)。
查看答案和解析>>
科目: 来源: 题型:
请回答下列问题:
(1)SO2的排放是造成酸雨的主要因素。某地区酸雨pH随时间的变化如下图所示。请用化学方程式表示该地区酸雨pH随时间增加而减小的原因______________________________。

(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是_______________________________________________________。
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及的化学反应为:SO2+2CO====2CO2+![]() Sx、CO+
Sx、CO+![]() Sx====COS、2COS+SO2====2CO2+
Sx====COS、2COS+SO2====2CO2+![]() Sx。其中COS分子的空间构型为______________。
Sx。其中COS分子的空间构型为______________。
(4)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀。请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为_____________。若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在硝化细菌的作用下将![]() 氧化为
氧化为![]() :
:![]() +2O2====
+2O2====![]() +2H++H2O,然后加入甲醇,
+2H++H2O,然后加入甲醇,![]() 和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式__________________________。
和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式__________________________。
查看答案和解析>>
科目: 来源: 题型:
依据上述信息,回答下列问题:
Ⅰ.若A为固体,F是盐,反应①是工业上制取K的重要反应,反应②为化合反应。
(1)G的电子式是_______________。
(2)工业上反应①在_______________(填工业设备名称)中进行。
(3)反应①的化学方程式为_____________________________________________。
Ⅱ.若A为气体,E为活泼金属单质,且K与“Ⅰ”中的K不同。
(4)物质A的分子式是_______________。
(5)反应②的离子方程式为_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)短周期元素中,原子最外层电子数和电子层数相等的元素有________种。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表1所示,其中C的化学式为________________;第三周期元素单质的熔点(℃)变化如下图Ⅰ所示,其中h的元素符号为________________。
氢化物 | 沸点/℃ |
A | 1 317 |
B | 100 |
C | 19.5 |
D | -33 |
E | -162 |
表1

图Ⅰ
(3)原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙。分子甲和离子乙含有相等的电子数,且乙的立体结构如图Ⅱ所示。请写出甲、乙反应的离子方程式_________________。

(X、Y可能相同也可能不同)
图Ⅱ
(4)第二、第三周期的某些元素中能形成具有图Ⅱ所示的结构单元的单质丙和化合物丁,丙和丁的晶体类型相同,且丙与丁在高温时能发生置换反应。若该反应中丙被破坏了1 mol共价键,则参加反应的丁的质量为__________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com