
科目: 来源: 题型:
方法一:核磁共振仪可以测定有机分子里不同化学环境的氢原子及其相对数量。如乙醇(CH3CH2OH)的核磁共振氢谱有3个峰,其面积之比3∶2∶1,见下图所示。
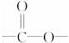
现测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图:
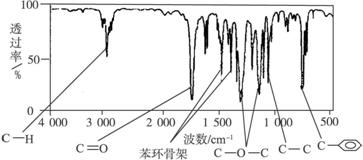
已知A分子中只含有一个苯环,且苯环上只有一个取代基,试填空。
(1)A的分子式为________________________________。
(2)A的结构简式为_____________________________________。
(3)A的芳香类同分异构体有多种,请按要求写出其中两种结构简式:
①分子中不含甲基的芳香酸:________________________________;
②遇FeCl3显紫色且苯环上只有两个取代基的芳香醛:_______________________________。
查看答案和解析>>
科目: 来源: 题型:
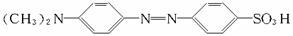
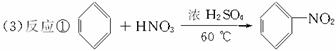
根据上述信息,按以下步骤(反应条件及有关试剂已略去)可以从烃A合成指示剂甲基橙。

试填空。
(1)写出A、D的结构简式:
A______________________________,D______________________________。
(2)在反应①、②、③中属于取代反应的是___________(填写序号):
(3)写出上述步骤中相关反应的化学方程式:
反应①_______________________________________________________________。
反应②_______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
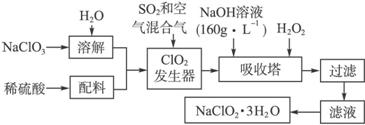
提示:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全;
③NaOH溶液(
试填空。
(1)该NaOH溶液的物质的量浓度为________ mol·L-1;若要计算该溶液溶质的质量分数,还需要的一个条件是__________________________________________________________。
(2)在发生器中鼓入空气的作用可能是_________(填字母序号)。
A.将SO2氧化成SO3,增强酸性
B.稀释ClO2以防止爆炸
C.将NaClO3氧化成ClO2
(3)吸收塔的温度不能超过
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是_______________________________________________________。
(5)要得到更纯的NaClO2·3H2O晶体必须进行的操作是____________(填操作名称)。
查看答案和解析>>
科目: 来源: 题型:

试填空。
(1)X的化学式为______________________,P中气体的化学式为___________________。
(2)实现G![]() H,欲不引进新的杂质,N可以选择下列物质中的___________(填序号)。
H,欲不引进新的杂质,N可以选择下列物质中的___________(填序号)。
①KMnO4 ②HNO3 ③H2O2 ④Cl2
(3)写出下列反应的离子方程式:
D![]() G____________________________________________________________。
G____________________________________________________________。
H![]() C____________________________________________________________。
C____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
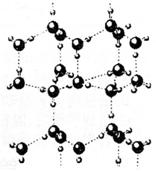
(1)1 mol冰中有___________ mol“氢键”。
(2)水分子可电离生成两种含有相同电子数的微粒,其电离方程式为_________________。
(3)用x、y、z分别表示H2O、H2S、H2Se的沸点(℃)则x、y、z的大小关系是__________。
(4)实验测得冰中氢键的作用能为18.8 kJ·mol-1,而冰的熔化热为5.0 kJ·mol-1,这说明______________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(1)用坩埚钳夹住一块擦去氧化膜的铝片,放在酒清灯火焰上灼烧,铝片表面接触火焰的部分变暗,片刻后变软;轻轻摇动,会左右摇晃,却不像蜡烛那样滴落。这是因为铝表面氧化膜的__________内层的铝并将其裹住,所以不易发生熔滴现象。试写出灼烧铝的化学方程式:________________________________________。
(2)取2条未用砂纸打磨过的铝片,一片浸入CuCl2稀溶液中其表面产生许多无色气泡,很快析出较多红色粉末状固体;而另一片浸入CuSO4稀溶液中现象一直不明显。试猜测产生这种现象差异的原因是___________________________________________________________。
(3)用砂纸打磨一铝片使其表面较粗糙,再将其放入CuSO4稀溶液中,2—3 min后,铝片表面有气泡,并有少量红色固体附着。试写出铝片表面附着红色固体的离子方程式为_____
_____________________________________________________________________。
(4)再取2条铝片,用砂纸擦去氧化膜,都浸入浓硝酸中,无显著变化,5 min后取出,用水洗净。其后将两铝片分别浸入CuCl2、CuSO4两种稀溶液中,现象同(2)。铝片浸入浓硝酸中无显著变化的原因是________________________________________________________。
(5)另取2条未用砂纸打磨过的铝片,都浸入氢氧化钠溶液中,片刻后其表面产生无色气泡,5 min后取出,用水洗净。其后将两铝片分别浸入CuCl2、CuSO4两种稀溶液中,现象与(2)相似。试写出铝的氧化膜与碱液反应的离子方程式:________________________________。
(6)向步骤(2)、(4)和(5)中的CuSO4稀溶液中滴入3—5滴NaCl稀溶液,铝片表面逐渐产生气泡,且有红色固体析出。
因此据步骤(2)、(4)、(5)和(6)的现象可以得出的结论是________________________。
查看答案和解析>>
科目: 来源: 题型:
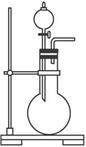
①该制气装置在加入反应物前,应事先进行的操作是__________________________。
②若用该装置制取O2,反应物除了可选择二氧化锰和____________(填试剂名称),还能选择____________(填物质的化学式)和水。
③利用该装置还可制取____________(选填下列字母序号)等气体。
A.H2 B.CO
(2)试指出以下银镜反应实验过程示意图的错误之处(可不填满,也可自添空格)。
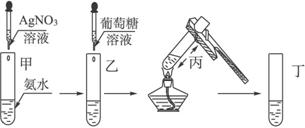
①________________ ;②___________________;③_____________________。
查看答案和解析>>
科目: 来源: 题型:
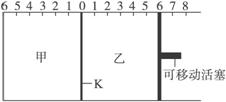
A.到达平衡时,甲容器中C的物质的量大于乙容器中C的物质的量
B.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
C.达到平衡后,隔板K最终停留在左侧刻度0—2之间
D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6处
查看答案和解析>>
科目: 来源: 题型:
![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
B.0.1 mol·L-1的NH4Cl和0.1 mol·L-1的NH3·H2O等体积混合后溶液中的离子浓度关系:c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中,离子浓度关系:c(Na+)=c(CH3COO-)
D.0.1 mol·L-1的NaHS溶液中离子浓度关系:c(OH-)=c(H+)-c(S2-)+c(H2S)
查看答案和解析>>
科目: 来源: 题型:
Pb+PbO2+4H++2![]()
![]() 2PbSO4+2H2O
2PbSO4+2H2O
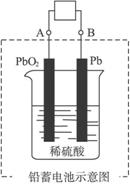
则下列说法正确的是
A.放电时:负极板上发生了还原反应
B.放电时:正极反应是Pb-2e-+![]() ====PbSO4
====PbSO4
C.充电时,铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O====PbO2+![]() +4H+
+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com