
科目: 来源: 题型:
A.NOx中x为1
B.氧化产物为H2SO4和Cu(NO3)2
C.若反应中电子转移1 mol,则被氧化的Cu2S为0.1 mol
D.氧化剂与还原剂的物质的量之比为22∶3
查看答案和解析>>
科目: 来源: 题型:
![]() B(g)+C(g);ΔH=a kJ/mol(a>0)
B(g)+C(g);ΔH=a kJ/mol(a>0)
2 min后反应达平衡,A为0.4 mol。下列叙述中不正确的是
A.B物质的反应速率为0.03 mol/(L·min)
B.充分反应后,反应吸收的热量为a kJ
C.达平衡后,保持温度和容器体积不变,再充入1 molA,平衡向正反应方向移动
D.若温度和容器体积不变,起始时充入B和C各0.5 mol,则达平衡时,A的物质的量仍为0.4 mol
查看答案和解析>>
科目: 来源: 题型:
A.若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子
B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键
C.CO2与SiO2晶体熔化时,所克服的微粒间相互作用相同
D.短周期元素离子aXm-和bYn-具有相同的电子层结构,若a>b,则n>m
查看答案和解析>>
科目: 来源: 题型:
A.向Na2CO3溶液中逐滴加入少量CH3COOH溶液![]() +2CH3COOH====2CH3COO-+H2O +CO2↑
+2CH3COOH====2CH3COO-+H2O +CO2↑
B.向NH4HSO4溶液中加入少量NaOH溶液![]() +OH-====NH3·H2O
+OH-====NH3·H2O
C.电解饱和食盐水2H++2Cl-![]() H2↑+Cl2↑
H2↑+Cl2↑
D.向![]() 溶液中通入少量CO2
溶液中通入少量CO2![]() +H2O+CO2
+H2O+CO2![]()
![]() +
+![]()
查看答案和解析>>
科目: 来源: 题型:
A.100 mL 0.1 mol·L-1NH4Cl溶液中含![]() 数为0.01 NA
数为0.01 NA
B.3.5g ![]() 原子中所含中子数为1.7 NA
原子中所含中子数为1.7 NA
C.标准状况下,
D
查看答案和解析>>
科目: 来源: 题型:
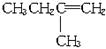
根据上述转化关系,回答下列问题:
(1)写出A、J的结构简式:A:________________;J:________________。
(2)指出反应类型:反应①:反应________________,反应②:________________反应。
(3)写出实现下列转化的化学方程式:
D![]() I:___________________________________________________________。
I:___________________________________________________________。
E+G![]() H:________________________________________________________。
H:________________________________________________________。
(4)G有多种同分异构体。其中含苯基(C6H5—)、甲基(CH3—)的同分异构体有三种。
如:![]() ,另两种的结构简式为____________、____________。
,另两种的结构简式为____________、____________。
查看答案和解析>>
科目: 来源: 题型:

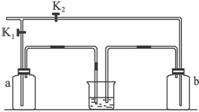
图Ⅰ 图Ⅱ
(1)写出生成Cl2的化学方程式:________________________________________________。
(2)分液漏斗中盛有液体,但打开分液漏斗的活塞时液体不能流下,可能的原因是_______
____________________________________________________________________。
(3)实验需要多瓶氯气,在更换集气瓶时,为了减少氯气逸散到空气中,将图Ⅰ中的B部分更换为图Ⅱ所示装置,可以用a、b集气瓶交替收集氯气。
请回答下列问题:
①检查集气瓶b是否漏气的方法是________________________________________________。
②若只用集气瓶a收集气体,在装置气密性良好并加入药品后,开始制取氯气,下一步的操作是____________________________________________________________________。
③如何认定集气瓶已收集满氯气?________________________________________________。
(4)①若用A装置作为制取乙烯的发生装置,应对A装置作何改进?________________。
②烧瓶中应放入碎瓷片,目的是__________________________________________________。
③写出实验室制取乙烯的化学方程式:____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
![]()
(1)若X具有强氧化性,举两例分别写出对应的A、B、C的化学式(FeS2不能填写)。
例1:A________________,B________________,C________________。 例2:A_____________, B______________,C______________。
(2)若X为较活泼的金属,向C的水溶液中滴加硝酸银溶液有不溶于稀硝酸的白色沉淀析出,则B可能的化学式是_______________。若将铜片和碳棒用导线连接后插入B的水溶液中,构成原电池,写出负极的电极反应式:__________________________________________。
(3)若上述(2)中C溶液保存时需加入少量X,理由是____________________________。
(4)若A是一种常见的无机化合物,请写出反应①的化学方程式:(只要求写一例)
____________________________________________________________________。
(5)某工厂用含FeS260%的硫铁矿通过上述途径制取硫酸。已知反应①中S的损失率为2%,反应②中S的转化率为90%,则100 t硫铁矿可生产98%的浓硫酸__________吨。
查看答案和解析>>
科目: 来源: 题型:阅读理解
信 息 | 问 题 |
①X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2 | (1)根据信息①,X一定不是____________(填序号)。 A.氢 B.碳 C.氧 D.硫 |
②上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26 | (2)这四种元素中是否可能有一种是铝元素?(填“可能”或“不可能”)____________ |
③向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀 | (3)白色沉淀物的化学式为: _____________________________ _____________________________ |
④向上述四种元素单质组成的混合物中加入足量的烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀 | (4)生成白色沉淀的离子方程式为:_____ ______________________________________ |
⑤X与W同主族 | (5)X与浓硫酸反应的化学方程式为:___ ______________________________________ |
查看答案和解析>>
科目: 来源: 题型:
A.pH<7,且c(Cl-)>c(H+)>c(![]() )>c(OH-)
)>c(OH-)
B.pH<7,且c(![]() )+c(H+)=c(Cl-)+c(OH-)
)+c(H+)=c(Cl-)+c(OH-)
C.pH>7,且c(![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
D.pH=7,且c (![]() )>c(Cl-)>c (H+)=c(OH-)
)>c(Cl-)>c (H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com