
科目: 来源: 题型:
A.在常温常压下,1 mol羟基(-OH)含有的电子数为10NA
B.在常温常压下,
C. 1 mol Na2O2与足量的CO2气体充分反应后,转移的电子总数为2NA个
D.标准状况下,NA个己烷分子所占的体积约为
查看答案和解析>>
科目: 来源: 题型:
A.水加热到很高温度都难以分解
B.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
C.乙醇可以任意比溶于水
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目: 来源: 题型:
(1)写出镁和含氮废水中的![]() 反应的离子方程式:
反应的离子方程式:
_____________________________________________________________________。
(2)已知金属镁是从海水中提取的无水MgCl2电解制得的,若处理![]() 的浓度为0.2 mol/m3)需用含MgCl20.5%(质量分数)的海水_________t。
的浓度为0.2 mol/m3)需用含MgCl20.5%(质量分数)的海水_________t。
(3)若要用金属铝除去含![]() 0.3mol废水中的氮,(设氮元素均以
0.3mol废水中的氮,(设氮元素均以![]() 的形式存在)至少需消耗金属铝__________g。
的形式存在)至少需消耗金属铝__________g。
查看答案和解析>>
科目: 来源: 题型:
(Ⅱ)某有机物Q只含碳、氢、氧三种元素,经测定分子中碳、氢、氧原子个数比为10∶16∶3,且相对分子质量不大于200;已知Q能与NaHCO3溶液反应,各有机物的转化关系如下图所示。
已知:
R—CH=CH—R′![]() R—COOH+R′—COOH
R—COOH+R′—COOH
R—CH=CH—R′![]() R—CHO+R′—CHO
R—CHO+R′—CHO

(1)写出Q的结构简式__________________________________________________________
(2)写出反应③的化学方程式____________________________________________________
(3)写出反应④的离子方程式____________________________________________________
(4)写出和D含有相同官能团的同分异构体的结构简式__________________(任意一种)
查看答案和解析>>
科目: 来源: 题型:
他们设计如下制取氯气并验证其性质的实验:

选用_________装置(填写装置的序号)制取氯气。

(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已部分被氧化(简述实验步骤):
____________________________________________________________________
(3)写出在D装置中发生反应的离子方程式:______________________________________
(4)该实验存在明显的缺陷,请你提出改进的方法。
____________________________________________________________________
(5)该小组又进行了如下实验:称取漂白粉
查看答案和解析>>
科目: 来源: 题型:

(1)A与B按物质的量之比n(A)∶n(B)=1∶2完全反应生成G
(2)B与C按物质的量之比n(B)∶n(C)=3∶1完全反应生成F
(3)C与D按物质的量之比n(C)∶n(D)=1∶3完全反应生成E
请填空:
(1)物质B是_______________,物质D是_______________;
(2)B与C反应生成F的化学方程式为:_______________;
(3)A与H反应生成I的化学方程度为:_______________。
查看答案和解析>>
科目: 来源: 题型:
![]()
A.甲容器中反应的平均速率![]() (B)=0.3 mol/(L·min)
(B)=0.3 mol/(L·min)
B.化学方程式中计量数b=1
C.乙容器中反应达到平衡时所需时间大于4 min
D.T ℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8 mol/L,起始时,向丙容器中加入3 mol C和2 mol D
查看答案和解析>>
科目: 来源: 题型:
① | He -268.8 | (a) -249.5 | Ar -185.5 | Kr -151.7 |
② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
③ | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
④ | H2O 100.0 | H2S -60.2 | (d) -42.0 | H2Te -1.8 |
⑤ | CH4 -161.0 | SiH4 -112.0 | GeH4 -90.0 | (e) -52.0 |
对应表中内容,下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第②组物质均有氧化性;第③组物质对应水溶液均是强酸
C.第④组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
D.上表物质中HF和H2O由于氢键的影响,其分子特别稳定
查看答案和解析>>
科目: 来源: 题型:
A.酸性:HClO4>HBrO4>HIO4;碱性:NaOH>KOH>RbOH
B.沸点:Cl2<Br2<I2;熔点:Na<K<Rb
C.可燃性:H2O<NH3<CH4;还原性:HCl<H2S<PH3
D.还原性:Na>Mg>Al;氧化性:P>S>Cl2
查看答案和解析>>
科目: 来源: 题型:
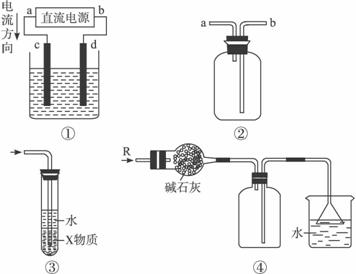
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com