
科目: 来源: 题型:
A.元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果
B.离子方程式不仅可以表示一定物质间的某个反应,而且可以表示所有同一类型的离子反应
C.除了加入电解质可使某些胶体聚沉外,将两种带相反电荷的胶体混合,也能发生聚沉
D.不同的化学反应具有不同的反应速率,这说明参加反应的物质的性质是决定化学反应速率的重要因素
查看答案和解析>>
科目: 来源: 题型:
A.碳酸氢钠溶液显碱性:![]() +H2O
+H2O![]() H2CO3+OH-
H2CO3+OH-
B.向沸水中滴加三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
C.向次氯酸钠溶液中通入二氧化硫:Ca2++2ClO-+SO2+H2O====CaSO3↓+2HClO
D.向氢氧化钡溶液中滴加硫酸铜溶液:Ba2++![]() ====BaSO4↓
====BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
A.Na2O2、NH4Cl、NaCl、Na2SO4 B.Na2CO3、BaCl2、K2S、盐酸
C.KHCO3、Ca(OH)2、MgCl2、硫酸 D.FeO、AlCl3、Na2SiO3、硝酸
查看答案和解析>>
科目: 来源: 题型:
A.1 mol甲基所含有的电子数为10NA
B.标准状况下,22.4 LCO2与CO的混合气体中含有的碳原子数为NA
C
D.
查看答案和解析>>
科目: 来源: 题型:
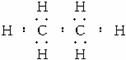
B、C、D、F四种元素均能与A形成等电子的四种分子,且化合物中各原子的个数比如下表:
化合物 | 甲 | 乙 | 丙 | 丁 |
原子个数比 | B∶A=1∶3 | C∶A=1∶2 | D∶A=1∶1 | F∶A=1∶1 |
(1)C的元素符号为___________,元素F在元素周期表中的位置为___________,化合物乙的分子式___________。
(2)丙在一定条件下可生成单质D2;在101 kPa时,0.5 mol D2与A2完全反应生成液态物质放出的热量为285.8 kJ,该反应的热化学方程式为___________。
(3)0.1 mol/L离子化合物EAB2D4溶液呈弱酸性,则溶液中离子浓度的大小顺序为_________________。
(4)化合物甲的电子式为___________,A、B、C、D四种元素中的某三种能形成多种与甲分子等电子的化合物,请写出其中任意一种化合物的分子式___________。
查看答案和解析>>
科目: 来源: 题型:
![]()
请回答下列问题:
(1)二甘醇的分子式为________________;
(2)由乙烯制备化合物A的化学方程式为________________;由化合物A制备B的反应条件是______________,由化合物B合成二甘醇的化学方程式为___________,该反应的类型属于____________反应;
(3)1,2-丙二醇在一定条件下可转化为分子式为C3H6O2的物质。该物质具有多种同分异构体,请写出符合该分子式的含有不同官能团类型的三种同分异构体的结构简式___________、___________、___________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
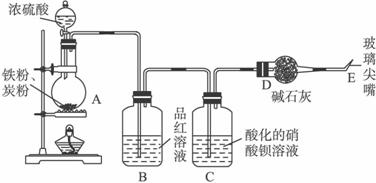
(1)在未点燃酒精灯前,该同学观察到B中没有出现明显的现象,这是因为_____________;点燃酒精灯后,烧瓶内可能发生的化学反应为:
2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
随着反应的进行,还可能发生其他反应,试写出其中两个反应的离子反应方程式:________
____________________________________________________________________。
(2)当反应进行一段时间后,在C瓶中观察到有白色沉淀产生,该沉淀是_______(填化学式),在点燃E处产生的气体之前要先进行验纯,请简述操作及有关现象______________。
(3)在烧瓶中加入碳粉,可以使E处产生气体的速率加快,原因是:________________。
(4)反应结束后,安装好过滤装置。先用少量热水通过过滤器,以提高它的温度,然后将烧瓶中的溶液趁热过滤。将滤液转入试管中,用橡皮塞塞住管口,静置、冷却,可以看到硫酸亚铁晶体在试管中结晶析出。将析出的晶体过滤、干燥、称重,得硫酸亚铁晶体
已知:硫酸亚铁晶体在受热时发生的反应为:
2FeSO4·xH2O![]() Fe2O3+SO2↑+SO3↑+2xH2O。请回答:
Fe2O3+SO2↑+SO3↑+2xH2O。请回答:
①提高过滤器温度的目的是__________________;
②用橡皮塞塞住管口是为了_________________;
③求该晶体中所含结晶水的个数(要求写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
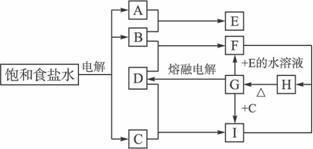
(1)分别写出B、D的化学式:B_____________,D_____________;
(2)写出G的熔融液发生电解时的化学方程式:________________;
(3)写出下列反应的离子方程式:
①F与I的水溶液反应________________;
②分析I物质的水溶液呈碱性的原因_____________________(要求用离子方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
A.大于0.3 mol,小于0.6 mol B.等于0.3 mol
C.小于0.3 mol D.等于0.6 mol
查看答案和解析>>
科目: 来源: 题型:
A.平均相对分子质量 B.密度
C.容器内的压强 D.物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com