
科目: 来源: 题型:
A.这是一个氧化还原反应 B.臭氧与氧气是氧的同素异形体
C.臭氧与氧气是氧的同位素 D.产生的臭氧可以填充“臭氧空洞”
查看答案和解析>>
科目: 来源: 题型:
①工业上合成氨的生产条件是___________、___________、___________。
②该时间段用N2表示反应速率时v(N2)=___________mol/(L·min)。
③平衡时H2的转化率___________。
(2)等物质的量CaCO3和KHCO3组成的混合物?
①则生成CO2体积(标准状况)___________。
②若该
查看答案和解析>>
科目: 来源: 题型:阅读理解

①设计甲装置的目的是_________________。甲装置__________(填“能”或“不能”)用乙装置来代替。
②装置乙中盛有的液体是__________,该装置可看作是一个___________(填某仪器名称)。
(2)在氮的化合物中,有一类盐叫亚硝酸盐,如亚硝酸钠(NaNO2)等。NaNO2是一种潜在的致癌物质,过量或长期使用会对人产生危害。由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生过被误当食盐使用的事件。已知:HNO2是一种弱酸,不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2;AgNO2是一种难溶于水易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白中应含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是_____________。
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
②下列说法中,能用来区别NaNO2和NaCl的是______________。
A.测定这两种溶液的pH
B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别
③把新制氯气通入到NaNO2溶液中,氯水褪色,生成NaNO3和HCl,请写出此反应的离子方程式______________。
④为了测定某样品中NaNO2的含量,可以使用标准?KMnO4?溶液进行滴定,试回答:KMnO4溶液在滴定过程中作____________(填“氧化剂”或“还原剂”),该滴定过程_____________(填“要”或“不要”)另加指示剂。
⑤已知HNO2的酸性比醋酸略强,某同学在家中进行鉴别NaNO2与NaCl的实验,但他家中只有浓醋酸,请问该实验能否成功?____________(填“能”或“不能”),请说明理由_______
_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
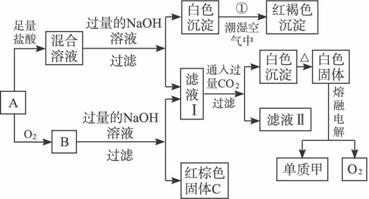
(1)单质乙的化学式为_________________________________________________。
(2)单质甲与红棕色固体在高温下反应的化学方程式_______________________________。
(3)反应①的化学方程式_________________________________________________。
(4)若向滤液Ⅰ中加入过量的盐酸,写出有关反应的离子方程式_____________________。
(5)向20 mL浓度为1 mol/L的甲的氯化物水溶液中加入1 mol/L的NaOH溶液,生成沉淀
查看答案和解析>>
科目: 来源: 题型:
(1)元素符号:A_________、B__________、C__________、D__________、E_________。
(2)写出B2与X反应的方程式_________________________________。
(3)离子化合物A4B3D2的名称是___________,其水溶液呈酸性的原因是_________________(用离子方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
B.0.2 mol/L的NaHCO3溶液中:c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)
)>c(OH-)
C.某溶液的pH=6,则该溶液一定显酸性
D![]() )=c(Cl-)
)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
A.在NaCl晶体中,每个Na+周围与它最近且距离相等的Na+有12个
B.电解饱和食盐水,在阴极得到的气体是氢气
C.2H2(g)+O2(g)====2H2O(g);ΔH=-484 kJ/mol,则氢气的燃烧热为242 kJ/mol
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
查看答案和解析>>
科目: 来源: 题型:
A.H+的物质的量相同
B.两种酸的物质的量浓度相同
C.H+的物质的量浓度相同
D.中和相同体积、相同浓度的NaOH溶液,所用两种酸的体积相同
查看答案和解析>>
科目: 来源: 题型:
A.酸性强弱:盐酸>醋酸>碳酸>次氯酸 B.热稳定性:HF<HCl<HBr<HI
C.微粒直径大小:S2->Cl->Al3+>Mg2+ D.沸点高低:NH3<PH3<AsH3<SbH3
查看答案和解析>>
科目: 来源: 题型:
A.1 mol Na2O2与足量的水反应,转移的电子数为2NA
B.标准状况下,
C.常温常压下,![]() )中共价键数为3NA
)中共价键数为3NA
D.常温下,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com