
科目: 来源: 题型:
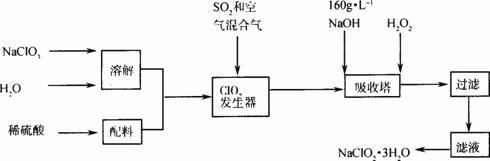
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下才安全。
(1)
(2)发生器中鼓入空气的作用可能是___________(填序列号)
a.将SO2氧化成SO3,增强酸性 b.稀释ClO2以防止爆炸 c.将NaClO2氧化成ClO2
(3)吸收塔内的反应的化学方程式为_________________,吸收塔的温度不能超过
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是___________________________________。
(5)吸收塔中为防止NaClO2被还原成NaCl,所以还原剂的还原性应适中,除H2O2外,还可以选择的还原剂是_________________(填序列号)。
a.Na2O2 b.Na2S c.FeCl2 d.PbO
(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是__________(填序列号)
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进行的操作是____________(填操作名称)
查看答案和解析>>
科目: 来源: 题型:

图6-5
(1)若A是一种紫红色金属,气体D能使品红溶液褪色,加热时又可以恢复原色。写出反应①的化学方程式:______________________,气体D与另一种气体H混合后生成一种淡黄色固体W,写出该反应的化学方程式:______________________;
(2)若A是一种金属单质,D是最轻的气体,B能否是NaOH溶液?___________(填“能”或“否”)
(3)若A是金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈蓝色。
写出反应①的离子方程式:____________________________________________;
写出反应②的离子方程式:____________________________________________;
查看答案和解析>>
科目: 来源: 题型:
(1)电解时,在阳极附近的溶液中,将先后观察到什么现象?请写出先后相应发生的两步阳极反应式。
______________________________________________________________________
(2)写出第二步电解的化学方程式:______________________。
(3)如此分步电解的理论根据是什么?______________________。
查看答案和解析>>
科目: 来源: 题型:
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.089 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
(1)用元素代号标出它们在周期表中对应位置

(2)C、E形成化合物为______________(填化学式),周期表有些元素存在“对角线相似”现象,请写出D的单质与强碱溶液反应的离子方程式:______________________;并用电子式表示其氯化物的形成过程____________________________________________________________。
(3)有一类无机化合反应的通式可以表示为:单质+化合物(1)=化合物(2)。请写出满足以下要
求的4个此类无机化合反应的化学方程式:
①所涉及的元素的原子序数都小于30,②4种单质分属4个不同族。
_______________________________________,_______________________________________,
_______________________________________,_______________________________________。
(4)M为金属元素铼(Re),铼是自然界中最后一种被诺达克等三位科学家于1926年发现的元素。他们从数以吨计的含有多种元素的矿石中,通过复杂的工艺一点一滴地富集浓缩,才制得了仅2mg的金属铼。现代工业上采用的方法是:于
①元素铼的原子序数为_____________,铼元素发现如此艰难和时间上如此漫长的原因:
____________________________________________________________________。
②写出现代工业上用氢气冶炼金属铼的化学方程式,并标出电子转移的方向和数目:_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:

图6-4
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________________。
(2)烧杯间填满碎纸条的作用是_______________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大”、“偏小”或“无影响”)。
(4)实验中60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___________(填“相等”或“不相等”),所求中和热___________(填“相等”或“不相等”),简述理由:_____________________________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___________(均填“偏大”、“偏小”或“无影响”);用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热的数值会___________(均填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
A.17.5% B.17.7% C.21.2% D.35%
查看答案和解析>>
科目: 来源: 题型:
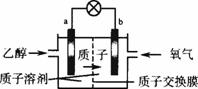
图6-3
A.a极为电池的正极
B.电池正极的电极反应:4H++O2+4e-=2H2O
C.电池工作时电子由b极沿导线经灯泡再到a极
D.设每个电子所带电量为qC,则1mol乙醇被氧化产生12q×6.02×
查看答案和解析>>
科目: 来源: 题型:
A.方程式中x=4
B.达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=3:1
C.若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,正逆反应的化学反应速率变小
D.在t℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则应再充入a/4molB
查看答案和解析>>
科目: 来源: 题型:
![]()
图6-2
A.当A是正盐、X是强酸时,D是酸性氧化物
B.当X是强碱溶液时,B一定是NH3
C.B可能是单质
D.D可能是一种酸
查看答案和解析>>
科目: 来源: 题型:
A.二氧化硅晶体的网状结构中,由共价键形成的最小环上有6个原子
B.在CsCl晶体中每个Cs+(或Cl-)周围都紧邻8个Cl-(或8个Cs+)
C.白磷晶体中,微粒之间通过共价键结合,键角为60°
D.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键不被破坏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com