
科目: 来源: 题型:
A.加入纯Cu将Fe2+还原
B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4—5
查看答案和解析>>
科目: 来源: 题型:
A.铍(Be)的氧化物的水化物可能具有两性
D.砹(At)为有色固体HAt不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
查看答案和解析>>
科目: 来源: 题型:
A.0.01 mol.L-1 B.0.02 mol·L-1
C.0.04 mol·L-1 D.0.08 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
B.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO
C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D.BeCl2水溶液的导电性强,故BeCl2是离子化合物
查看答案和解析>>
科目: 来源: 题型:
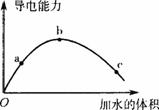
图11-4
A.a、b、c三点溶液的pH:a>b>c
B.用湿润的pH试纸测量c处溶液的pH,比实际pH偏小
C.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D.若在“O”点醋酸双聚成八元环分子,则其结构为:
![]()
查看答案和解析>>
科目: 来源: 题型:
A.N1=N2 B.N1>N2
C. N1< N2 D.c(F-)>c(CN-)
查看答案和解析>>
科目: 来源: 题型:
A.Al14与ⅡA族元素性质相似
B.Al13与卤素性质类似
C.Al13在气相中与HI反应的方程式可表示为:Al13+HI=HAl13I
D.Al13超原子中Al原子间是通过离子键结合的
查看答案和解析>>
科目: 来源: 题型:

图11-3
A.锌为负极,Ag2O为正极
B.放电时正极附近溶液的pH升高
C.放电时负极附近溶液的pH升高
D.溶液中阴离子向正极方向移动,阳离子向负极方向移动
查看答案和解析>>
科目: 来源: 题型:
①KIO3+SO2+H2O→I2+H2SO4+KHSO4 ②KIO3+SO2+H2O→KI+H2SO4则下列说法正确的是( )
A.检气管法是按照反应①原理设计的
B.检气管法是按照反应②原理设计的
C.反应①②均可以设计成检气管法,但考虑到相同量KIO3①消耗SO2少,所以检气管法是按①设计的
D.反应①②均可以设计成检气管法,但考虑到相同量KIO3②消耗SO2多,所以检气管法是按②设计的
查看答案和解析>>
科目: 来源: 题型:
![]()
图11-2
A.N4属于一种新型的化合物 B.N4与N2互为同素异形体
C.N4沸点比P4(白磷)高 D.1molN4气体转变为N2将吸收882kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com