
科目: 来源: 题型:
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.H2O的沸点比H2S的沸点高
C.金刚石的硬度、熔点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的溶点依次降低
查看答案和解析>>
科目: 来源: 题型:
A.FeSO4+Zn![]() ZnSO4+Fe
ZnSO4+Fe
B.2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
C.FeSO4+2KOH![]() Fe(OH)2↓+K2SO4
Fe(OH)2↓+K2SO4
D.10FeSO4+2HIO3+5H2SO4![]() 5Fe2(SO4)3+I2+6H2O
5Fe2(SO4)3+I2+6H2O
查看答案和解析>>
科目: 来源: 题型:
A.溶液中溶液粒子不带电,胶体中分散质粒子带电
B.溶液中无“丁达尔”现象,胶体中有“丁达尔”现象
C.溶液中溶质粒子可以穿过滤纸,胶体中分散质粒子不能穿过滤纸
D.溶液中溶质粒子运动有规律,胶体粒子运动无规则
查看答案和解析>>
科目: 来源: 题型:
(1)若x=2,则平衡时甲、乙两容器A的物质的量__________(填“相等”或“不相等”),此时甲中A的体积分数为__________,甲、乙两容器中的压强之比为__________。
(2)若x=4,平衡时甲、乙两容器中的压强之比为__________。
(3)若x=4,平衡后向甲容器中再加3 mol A和1 molB,C的体积分数__________(填“大于”“小于”或“等于”)0.2。
查看答案和解析>>
科目: 来源: 题型:
已知:①NO+NO2+2OH-![]() 2
2![]() +H2O
+H2O
②气体液化温度:NO2:

(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B 乙:A→B→C→E 丙:A→F→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO(填“能”或“不能”)
甲:_________;乙:_________;丙:_________。
用化学方程式表示不能验证的主要原因(若三个实验方案都能验证,则此小题不用回答):
甲方案:____________________________________;
乙方案:____________________________________;
丙方案:____________________________________。
(2)实验开始时首先通入足量的N2,其目的是:___________________________。
(3)确认气体中含NO的现象是:___________________________。
(4)如果O2过量,则装置B中发生反应的离子方程式是:_____________________________。
查看答案和解析>>
科目: 来源: 题型:
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L-1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是___________。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
方法 | 需测定的数据 |
① | 测定产生的H2的体积 |
② |
|
[实验二]向实验一的锥形瓶里滴加1 mol·L-1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式:___________________。
[实验三]取实验二的锥形瓶里的溶液10mL,向其中滴加amL c1 mol·L-1NaOH之后,改成滴加c2mol·L-1 HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如图所示。据此,回答下列问题:

(1)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体积的两倍,则c1/c2=__________;
(2)所加入NaOH溶液的体积a=________mL。
查看答案和解析>>
科目: 来源: 题型:
根据以上信息,回答下列问题:
(1)A和D氢化物中,沸点较低的是_________(填“A”或“D”);A离子和B离子中,半径较小的是_________(填离子符号)。
(2)元素C在元素周期表中的位置是__________________。
(3)写出C的最高价氧化物的水化物分别与B、D的最高价氧化物的水化物反应的离子方程式__________________、__________________。
(4)下图表示由上述五种元素中的两种元素所形成的离子化合物的晶胞(晶胞是在晶体中具有代表性的最小重复单元)。阳离子(用“●”表示)位于该正方体的顶点和面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的化学式可能是_________、_________。

查看答案和解析>>
科目: 来源: 题型:

(1)A是_________,C是_________,F是_________(均填化学式)。
(2)A与热盐酸反应的离子方程式为_________。
(3)写出该框图中由B→E的化学方程式_________。
查看答案和解析>>
科目: 来源: 题型:
A.容量瓶 B.蒸馏烧瓶 C.滴定管 D.量筒 E.烧杯 F.蒸发皿 G.分液漏斗
①有温度标志的有__________(填序号);
②使用时必须检查是否漏水的有__________(填序号);
③对允许加热的仪器,加热时必须垫上石棉网的有_________(填序号);
(2)现用物质的量的浓度为a mol/L的标准NaOH溶液去测定V mL盐酸的物质的量浓度,下图是碱式滴定管中液面在滴定前后的读数:
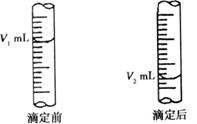
c(HCl)=_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com