
科目: 来源: 题型:
产品标准 产品等级 配料 碘含量(以Ⅰ计算) 分装日期 分装企业 | GB5461 一级 食盐、碘酸钾、抗结剂 20—50mg/kg 2007.1.25
|
1.上述精制盐属于_________(填“纯净物”或“混合物”)。
2.如果含碘量达到50mg/kg,则精制食盐中碘酸钾的质量分数为___________。
3.配平下列化学方程式。
______KIO3+______KI+______H2SO4![]() ______K2SO4+______I2+______H2O
______K2SO4+______I2+______H2O
(1)反应中作氧化剂的是________;
(2)当溶液中生成0.5 mol I2时,电子转移总数为________________个。
4.已知:I2+2![]()
![]() 2I-+
2I-+![]() 某学生测定食用精盐的碘含量,步骤为:
某学生测定食用精盐的碘含量,步骤为:
a.准确称取W g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3和KI完全反应;
c.以淀粉为指示剂,逐滴加入物质的量浓度为
2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好完全反应。
(1)判断c中反应恰好完全的依据现象是________________;
(2)b中反应所产生的I2的物质的量是________________mol;
(3)计算:根据以上实验和包装袋上的说明所测精制盐的碘含量(以含W的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
①将干燥的氯气在
②有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77
| 137
| 遇水生成HCl、SO2、S; |
设计实验装置图如下:
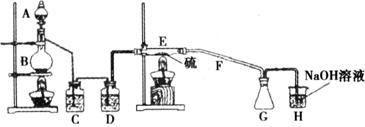
1.写出标号仪器名称:A____________、B____________;
2.B容器中反应的离子方程式____________;
3.由于S2Cl2遇水生成HCl、SO2和S,因此在G与H两装置之间增加_________装置;
4.写出所盛试剂的名称:C中__________、D中__________;
5.F仪器的名称__________,它的作用是__________;
6.如果在加热E时温度过高,对实验结果的影响是_________,在F中可能出现的现象是__________________;
7.检查整套装置气密性的方法是___________________________;
8.制得的S2Cl2粗品中可能混有的杂质是(任写一种)_________,为了提高S2Cl2的纯度,关键的操作是控制好温度和____________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.用湿润的pH试纸测定某稀醋酸溶液的pH
B.配制Al2(SO4)3溶液时,加入少量的稀硫酸
C.为了除去苯中混有的少量苯酚,加入足量浓溴水,充分搅拌后过滤分离
D.如果苯酚浓溶液沾到皮肤上,应立即用酒精擦洗
E.乙酸乙酯的制备中长导管应伸入到饱和碳酸钠溶液中以利于完全吸收
F.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2—3次
G.除去混在甲烷中的乙烯,将混合气体通入酸性高锰酸钾溶液
J.用碱式滴定管量取20.00mL0.1000mol/LKMnO4溶液
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

已知:通电一段时间后,C极上出现大量的红色铜单质。
1.电池的正极是_________(填“A”或“B”);
2.D电极的名称叫_________(填“正”“负”“阴”或“阳”),其电极反应式为:__________________;
3.乙装置的名称叫_________池(填“原电”或“电解”);检验F极上产生的气体的方法为__________________。装置中总反应的化学方程式为__________________。若向溶液中滴人酚酞试液,在_________极(填“E或“F”)显红色。
4.如果通电过程中若有0.4mol电子通过,则C极中析出铜的质量为_________;D极上产生的气体体积为_________(设为标准状况下)。
5.如果将甲改装成铜的电解精炼装置,则粗钢板应作_____极(填“C”或“D”),粗铜电极上的电极反应(主要的)_________。
查看答案和解析>>
科目: 来源: 题型:
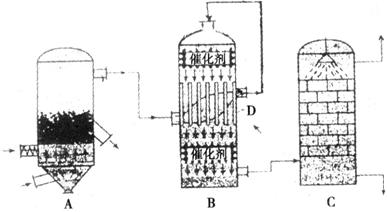
1.A设备叫沸腾炉。强大的空气将矿粒吹成“沸腾着的液体”状,其作用是_____________。
2.B设备的名称是_________,B中反应选择的条件__________________________________。
3.C设备叫吸收塔。用于吸收SO3的液体是98.3%的硫酸,不用水的目的是____________________________________。
4.工厂的尾气在排放之前要用_________吸收,防止对空气的污染;排出的污水含有硫酸等杂质,常用________中和处理。
查看答案和解析>>
科目: 来源: 题型:
①C2H2(g)+H2(g)![]() C2H4(g)
C2H4(g)
②CH4(g)![]() H2(g)+1/
H2(g)+1/
③C(s)+2H2(g)![]() CH4(g);ΔH=-XkJ·mol-1
CH4(g);ΔH=-XkJ·mol-1
④C(s)+1/2H2(g)![]() 1/
1/
⑤C(s)+H2(g)![]() 1/
1/
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③—⑤式中关于X、Y、Z的大小顺序排列正确的是( )
A.X>r>Z B.X>Z>Y C.Y>X>Z D.Z>X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com