
科目: 来源: 题型:
A.随着温度的升高,碳酸钠溶液的pH减小
B.pH=3的酸溶液稀释100倍后,pH=5
C.在室温下,pH=3的盐酸跟pH=11的氨水等体积混合,混合后pH大于7
D.对室温下pH、体积都相同的醋酸和盐酸分别加足量锌充分反应后,产生的氢气一样多
查看答案和解析>>
科目: 来源: 题型:
A.pH为2的溶液:![]() 、Fe3+、Cl-、I-
、Fe3+、Cl-、I-
B.滴加石蕊试液显红色的溶液:Fe2+、Mg2+、K+、![]()
C.水所电离出来的c(OH-)=10-13 mol·L-1的溶液:Na+、![]() 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为C6H5ONa的溶液:![]() 、K+、Ba2+、Cl-
、K+、Ba2+、Cl-
查看答案和解析>>
科目: 来源: 题型:
A.钢铁在潮湿空气中发生吸氧腐蚀而生锈时正极上的反应为O2+4OH-+4e-![]() 2H2O
2H2O
B.用惰性电极电解100 mL饱和食盐水,生成标准状况下112 mL H2,电解液的pH约为13
C.用惰性电极电解NaOH稀溶液,一段时间后,溶液中溶质的质量分数一定不变
D.用电解法精炼粗钢时,粗钢作阴极
查看答案和解析>>
科目: 来源: 题型:
A.1 mol H2O2与MnO2充分作用后,转移2NA个电子
B.标准状况下,
C.标准状况下,
D.1 mol白磷分子中所含共价键数为4NA
查看答案和解析>>
科目: 来源: 题型:
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.月球土壤中含有丰富的质量数为3的氦,它可以作为未来核能的重要原料
C.乙醇汽油是多种烃的混合物
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
查看答案和解析>>
科目: 来源: 题型:
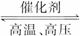
(1)若甲是中学化学中常见的红棕色粉末状固体,则单质A与NaOH溶液反应的离子方程式为_______________;A与甲反应在工业上一个重要用途是_______________。
(2)若乙的水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出乙在水溶液中发生电离时的电离方程式:_______________;丙与乙反应的化学方程式:_______________。

(3)若乙的水溶液呈弱碱性,并可用作农业化肥,D通常状况下为气体,则进行下列研究:现将0.40 mol C和0.20 mol D充入
①若t1=10 min,则0至t1时间内C物质的平均反应速率为_______________;该反应在t2时达到平衡,其化学反应方程式为_______________。
②根据图中曲线变化情况判断,t1时刻改变的反应条件可能是_______________。
a.加入了催化剂
b.降低了反应的温度
c.向容器中又充入了气体D
查看答案和解析>>
科目: 来源: 题型:
(1)写出A、C、E三种元素的名称。
A._______________;C._______________;E._______________。
(2)A、B形成的化合物与DB2反应生成一种强酸的化学方程式为_______________。
(3)已知DB2在一定条件下可转化为DB3,1 mol DB2充分反应,放出98.3 kJ的热量,该反应的热化学方程式是_______________,工业上进行这一反应的设备是_______________,反应的适宜条件为_______________。
(4)用铂作电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为________;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是_______________;若改用铁棒作阳极材料,则阳极的电极反应式为_______________。
查看答案和解析>>
科目: 来源: 题型:
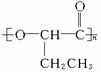
(1)A的结构简式是_______________;C的结构简式是_______________。
(2)A分子中含有官能团名称是_______________、_______________。
(3)A可以在一定条件下自身聚合形成一种高分子化合物,写出该聚合物的结构简式_______________。
(4)A在一定条件下可脱去一分子水,形成能使溴的四氯化碳溶液褪色的化合物F,F的结构简式是_______________。
(5)A与乙酸在一定条件下反应的化学方程式是_______________。
查看答案和解析>>
科目: 来源: 题型:
请回答下列问题:
(1)从以下仪器中选出本实验不需要使用的仪器(用字母填写)_______________。
A.托盘天平 B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚 H.干燥器 I.泥三角 J.石棉网 K.三脚架 L.药匙 M.坩埚钳
(2)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?
答:___________________________________。
(3)做此实验,至少应进行称量操作_______________次,至少加热_______________次。
(4)实验步骤⑥的目的是_____________________________________________。
(5)实验后得到以下数据:
①加热前质量:W1(容器),W2(容器+晶体);②加热后质量:W3(容器+无水硫酸铜)。
请写出硫酸铜晶体中结晶水含量,用质量分数表示的计算式(含W1、W2、W3)为:_____________。
(6)若操作正确但实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有____________。
A.被测样品中含有加热不挥发的杂质
B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水
D.加热前所用的坩埚未完全干燥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com