
科目: 来源: 题型:
A.(![]() -b)mol B.(
-b)mol B.(
C.(a-3b)mol D.(
查看答案和解析>>
科目: 来源: 题型:
A.KMnO4 B.NaNO
查看答案和解析>>
科目: 来源: 题型:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入
(1)浓硫酸的作用是________________________;
若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式_____________。
(2)甲和乙两位同学分别设计了如下图两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。

根据有机物的沸点,最好采用_____________装置(填“甲”或“乙”)。
理由是_______________________________________。
(3)反应物CH3OH应过量,理由是_______________________________________。
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请在流程图中方括号内填入恰当操作方法的名称。

(5)以上流程中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到油层,其具体操作是____________________________________________________________________。
(6)通过计算,苯甲酸甲酯的产率为__________________________。
查看答案和解析>>
科目: 来源: 题型:
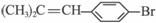
Ⅱ.烯醇式结构,即碳碳双键连接羟基(如CH2=CH—OH)不能稳定存在。
某有机物有如下转化关系:
(1)C7H5OBr中官能团名称为___________________________
(2)C7H5OBr与银氨溶液在加热时反应的化学方程式是(有机物写结构简式,下同):______________;实验现象是____________________________。
(3)从C7H5OBr合成D通常要经过几步有机反应,其中最佳顺序是______________(填序号)。
a.水解、酸化、氧化 b.氧化、水解、酸化
c.水解、酸化、还原 d.氧化、水解、酯化
(4)若按“最佳顺序”进行,写出一定条件下B![]() C的化学反应方程式:______________。
C的化学反应方程式:______________。
(5)A有一种同分异构体,能与Na反应放出H2,则其结构简式为:______________。
该有机物在一定条件下能发生加聚反应,其化学方程式为:____________________________。
该反应所形成的高聚物吸水性强,原因可能是____________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)①完成并配平该氧化还原方程式:
_____________+_____________+_____________NH4Cl![]() _____________+_____________+_____________+_____________NH3
_____________+_____________+_____________+_____________NH3
②发生还原反应的物质是_____________,被氧化的元素是_____________。
③若有
(2)普通锌—锰干电池是利用上述反应原理设计的,其结构如下图所示。回答下列问题:

①电池中电解质溶液为_______________________________________。
②正极材料为____________________________________________________;
正极电极反应为____________________________________________________。
③放电时![]() 向_______________(填“正极”或“负极”)移动。
向_______________(填“正极”或“负极”)移动。
④普通锌—锰电池的缺点是电量小、放电电流弱。为增大放电电流,可把负极锌片改为锌粉,其理由是____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)X元素位于周期表中第__________族(用字母表示)。
(2)X、Y、Z三种元素形成的单质中,氧化性最弱的是_____________(填化学式)。
(3)Y与Z可形成共价化合物Y2Z2,分子中Y与Z均满足8电子稳定结构,则Y2Z2的电子式为_____________。
(4)a溶液的pH_____________7(填“>”“<”或“=”),用离子方程式解释为_____________,若在a溶液中加入少量镁粉,可观察到的现象是_____________。
(5)取pH=0的W的最高价氧化物对应水化物的溶液100.0 mL于某容器中,加入
若设Cu、Ag的物质的量分别为x、y。欲求算x、y的值,可列出下列计算式:
Ⅰ.64x+108y=0.90,该计算式是依据________________________关系列出的;
Ⅱ.2x+y=1 mol·L -1×
查看答案和解析>>
科目: 来源: 题型:
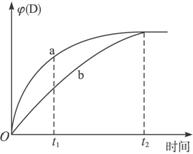
A.b曲线t2后,v正(B)=4v逆(D)
B.a曲线t1时,4v正(B)>v逆(D)
C.升高温度,可使曲线b变为曲线a
D.缩小反应容器的体积,可使曲线a变为曲线b
查看答案和解析>>
科目: 来源: 题型:
A
B.向Na2CO3溶液中加入少量NaHCO3固体,溶液pH减小
C.50 mL 1.0 mol·L-1的盐酸与60 mL 1.0 mol·L-1的盐酸分别跟50 mL 1.1 mol·L-1的NaOH溶液进行反应,中和热数值不相等
D.一定条件下,向水中加入少量NaHSO4,可使水的电离程度减小
查看答案和解析>>
科目: 来源: 题型:
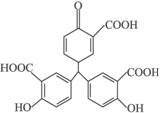
A.铝试剂分子中氢原子数目为16
B.1 mol 铝试剂最多消耗3 mol NaHCO3
C.铝试剂分子中所有碳原子可能在同一平面上
D.铝试剂能与FeCl3溶液发生显色反应
查看答案和解析>>
科目: 来源: 题型:
A.可用盐析的方法从油脂皂化反应后的混合物中分离出高级脂肪酸钠
B.实验室配制Fe(OH)3胶体是向沸水中滴入饱和FeCl3溶液,继续煮沸至溶液呈红褐色
C.从含有FeCl2、CuCl2的废液中回收Cu,可在废液中加盐酸调节其pH=1,用铜和石墨作电极进行电解。当阴极上有少量气泡产生时,表示铜已全部析出
D.检验纤维素的水解产物是在纤维素水解后的溶液中加入10 mL 1 mol·L-1的NaOH溶液,再加入5 mL 1 mol·L-1的CuSO4溶液,加热煮沸,观察现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com