
科目: 来源: 题型:
P4(s)+5O2(g)![]() P4O10;ΔH=-3 093.2 kJ·mol-1①
P4O10;ΔH=-3 093.2 kJ·mol-1①
4P(s)+5O2(g)![]() P4O10;ΔH=-2 954.0 kJ·mol-1②
P4O10;ΔH=-2 954.0 kJ·mol-1②
由此判断下列说法正确的是
A.白磷在空气中加热至
B.已知白磷分子为正四面体结构,则P—P键之间的夹角为60°
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
查看答案和解析>>
科目: 来源: 题型:
C.小于0.20 mol D.大于0.20 mol,小于0.40 mol
查看答案和解析>>
科目: 来源: 题型:
①加入Al能放出H2的溶液中:Fe2+、Al3+、![]() 、Cl-、S2-
、Cl-、S2-
②使pH=11的溶液中:Na+、![]() 、
、![]() 、S2-、
、S2-、![]()
③由水电离的c(H+)=10-12 mol·L-1的溶液中:Cl-、![]() 、
、![]() 、
、![]() 、F-
、F-
④加入Mg能放出H2的溶液中:Mg2+、![]() 、Cl-、K+、
、Cl-、K+、![]()
⑤使甲基橙变红的溶液中:Fe3+、![]() 、Cl-、K+、
、Cl-、K+、![]()
A.①③④ B.①②④ C.②④⑤ D.①②⑤
查看答案和解析>>
科目: 来源: 题型:
①若A的最高价氧化物对应水化物是强碱,则E的最高价氧化物对应水化物是强酸
②若A的单质既能与强酸又能与强碱反应且都放出氢气,则这五种元素在同一周期
③若A的阳离子比E的阴离子少8个电子,则D一定是非金属元素
④若D的最高价氧化物对应水化物是强酸,则E的单质在常温下为气态
⑤若B的单质是原子晶体,则B的氧化物是分子晶体
A.①②③ B.②③④ C.③④⑤ D.②④⑤
查看答案和解析>>
科目: 来源: 题型:
A.在熔融状态和水溶液中均不能导电的物质称为非电解质
B.HF、HCl、HBr、HI的熔点随相对分子质量增大而升高
C.通过化学反应制得1 mol O2,转移电子的数目一定是4NA
D.
查看答案和解析>>
科目: 来源: 题型:
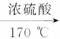
请回答下列问题:
(1)简述乙烯的一种重要工业用途:_____________________。
(2)实验室制取乙烯的化学方程式为________________________。
(3)D的结构简式为__________________。
(4)I(C6H10O4)有多种同分异构体,其中符合HOOC—COOC4H9的同分异构体共有___________种。
(5)写出下列转化的化学方程式并指出指定反应的反应类型。
E![]() F:__________________________。
F:__________________________。
G+H![]() I:___________________,反应类型:_________________________。
I:___________________,反应类型:_________________________。
查看答案和解析>>
科目: 来源: 题型:
H![]() CaC2O4↓(白色)+2H2O
CaC2O4↓(白色)+2H2O
为探究乙二酸晶体(H

回答下列问题:
(1)乙二酸晶体(H
(2)a处试剂的名称是________________,反应一段时间后a处的现象为____________。
(3)足量澄清石灰水的作用是________________。
装置乙不能缺少,理由是_________________。
(4)丙中b处逸出的气体可能是________________。检验的方法是_______________(用化学方程式表示)。
(5)简述检查上述装置气密性的方法:__________________。
(6)乙二酸还可能具有的性质是_________________。(填序号)
A.能与银氨溶液发生银镜反应 B.能使酸性KMnO4溶液褪色
C.能与Na2CO3反应生成CO2 D.能使蓝墨水褪色
查看答案和解析>>
科目: 来源: 题型:

请回答:
(1)H的化学式为_________________。
(2)若A是一种常见酸性氧化物,且可用于制玻璃。写出A和碳反应制半导体材料的化学方程式:_______________________。
(3)若A是第三周期某金属元素的单质,当F的水溶液过量时,G为可溶性盐;当F的水溶液不足时,G为沉淀。写出E与少量F的水溶液反应的离子方程式:_________________。
(4)若A是一种常用化肥的主要成分,E与F反应有白烟产生。E分子的结构呈____________形。若在标准状况下,用体积为V L的烧瓶收集满F后做喷泉实验,假设溶液充满烧瓶且溶质不扩散,则该溶液中溶质的物质的量浓度为__________________。(保留三位小数)
查看答案和解析>>
科目: 来源: 题型:
元素代号 | A | B | C | D | E | F | G |
部分化合价 | +1 | -2 | +5、-1 | +4、-2 | +4、-4 | +3 | +1 |
原子半径/nm | 0.037 | 0.074 | 0.099 | 0.102 | 0.117 | 0.143 | 0.186 |
分析上表中有关数据,并结合已学过的知识,回答下列问题。
(1)D元素在周期表中位于第_______________周期,第______________族。
(2)B与E所形成化合物的晶体类型是_______________。
D与G所形成化合物的电子式为___________________。
(3)B、D、G形成的一种化合物X在水溶液中显碱性,则X的化学式为_____________;将X投入稀盐酸中的现象是____________________。
(4)B的气态氢化物比D的气态氢化物沸点高,主要原因是_______________。
(5)A、B、G形成的一种化合物Y与C的单质在一定条件下反应时,生成的氧化产物与还原产物的物质的量之比为1∶5,则反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
A.两者都小于a% B.两者都大于a%
C.两者都等于a% D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com