
科目: 来源: 题型:
A.-2 B.0 C.+4 D.+6
查看答案和解析>>
科目: 来源: 题型:
A.碳酸氢铵溶液中加入NaOH溶液共热![]()
B.用碳酸钠溶液吸收少量二氧化硫2![]() +SO2+H2O====2
+SO2+H2O====2![]() +
+![]()
C.FeBr2溶液中加入过量的氯水2Fe2++2 Br-+2Cl2====Br2+4 Cl-+2Fe3+
D.硫酸镁溶液和氢氧化钡溶液反应![]() +Ba2+====BaSO4↓
+Ba2+====BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
①K+、![]() 、F- ②K+、Ba2+、Cl- ③Fe2+、Cl-、Br- ④K+、Na+、ClO-
、F- ②K+、Ba2+、Cl- ③Fe2+、Cl-、Br- ④K+、Na+、ClO-
A.①②③④ B.只有②③④
C.只有①③④ D.只有②③
查看答案和解析>>
科目: 来源: 题型:
①元素的种类 ②原子的种类 ③分子数目④原子数目 ⑤反应前物质的质量总和与反应后物质的质量总和 ⑥如果在水溶液中反应,则反应前与反应后阳离子所带的正电荷总数
A.①②③④ B.①②⑤⑥ C.①②④⑤ D.②③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
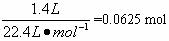
请回答下列问题。
(1)实验室制备NH3,下列方法中宜选用的是________(填序号)
①固态氯化铵与熟石灰混合加热
②固态氯化铵加热分解
③生石灰中滴加浓氨水
④氯化铵溶液与氢氧化钠溶液共热
(2)装置B中发生反应的化学方程式为______________;在实验过程中,加热Pt丝红热后,移去酒精灯,发现Pt丝还继续保持红热,由此可判断该反应是_____________________。
(3)装置C的作用是__________;装置C中的现象是__________;为确保D中尽可能多生成HNO3,所通入O2和NH3的体积比应大于__________。
(4)氨在高温下催化氧化时还有副反应发生:4NH3+3O2![]() 2N2+6H2O。若忽略装置中残留的气体体积,测得D中有1.0 mol·L-1的HNO3溶液150 mL,气球中收集的混合气体体积为400 mL(标准状况),其中NO2、O2与N2的体积比为2∶2∶1,则氧化成NO的氨占被氧化的体积分数为_________。
2N2+6H2O。若忽略装置中残留的气体体积,测得D中有1.0 mol·L-1的HNO3溶液150 mL,气球中收集的混合气体体积为400 mL(标准状况),其中NO2、O2与N2的体积比为2∶2∶1,则氧化成NO的氨占被氧化的体积分数为_________。
查看答案和解析>>
科目: 来源: 题型:
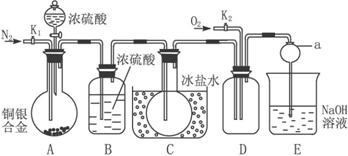
(1)反应前打开A部分的活塞K1,持续通一段时间氮气,其理由是_____________________
_____________________________________________________________________。
(2)若装置中缺B部分,其后果是__________________________________________________。
(3)反应结束后,打开D部分的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热的氧气,则瓶内气体的颜色比前者更深,其原因是__________________________。
(4)E部分中a仪器所起的作用是______________________________________________。
(5)已知该铜银合金的质量为15 g,加入40 mL 135 mol·L-1的浓硝酸,实验结束后,A部分烧瓶内溶液中的c(H+)=1 mol·L-1(假设反应中HNO3既无挥发也无分解,体积仍为40 mL)。
①参加反应硝酸的物质的量为_____________________。
②为测定铜银合金中铜的质量分数,还需要进行的主要实验操作是_____________________。
查看答案和解析>>
科目: 来源: 题型:
①称量a g胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;
②把步骤①中的溶液和沉淀转移至蒸发皿中,加热至溶液中的沉淀全部变成黑色氧化铜为止;
③过滤、洗涤、干燥,称量所得固体质量为b g;
④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气,如下图所示。
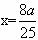
请回答下列问题。
(1)上述各步操作中,需要用到玻璃棒的是_________ (填写前面所述实验步骤的序号)。
(2)由胆矾制备氧化铜的产率(实际产量与理论产量的百分比)为_________×100%。
(3)为保证Cu2+沉淀完全,步骤①中溶液的pH应大于10。简述用pH试纸测定溶液pH的操作:____________________________________________________________________。
(4)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①—④后还应该进行的实验操作是(按实验先后顺序填写字母序号) _________。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(5)但有的同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是_________________________________。
查看答案和解析>>
科目: 来源: 题型:
下列实验操作或对实验事实的叙述正确的是_________。(填序号)
①用稀HNO3清洗做过银镜反应实验的试管;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③用碱式滴定管量取20.00 mL 0.100 0 mol·L-1 KMnO4溶液;
④用托盘天平称取10.50 g干燥的NaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
查看答案和解析>>
科目: 来源: 题型:
甲____________,乙____________,丙____________,丁____________,戊____________。
查看答案和解析>>
科目: 来源: 题型:
| 气体 | a | b | C |
A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
B | SO2 | 浓硫酸 | Cu | KmnO4酸性溶液 |
C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
D | CO2 | 稀硫酸 | CaCO3粉末 | 浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com