
科目: 来源: 题型:
A.镁的硬度大于铝 B.镁的熔沸点高于钙
C.镁的硬度大于钾 D.钙的熔沸点高于钾
查看答案和解析>>
科目: 来源: 题型:
A.酸性氧化物都可以与强碱溶液反应
B.与水反应生成酸的氧化物都是酸性氧化物
C.金属氧化物都是碱性氧化物或两性氧化物
D.不能与酸反应的氧化物一定能与碱反应
查看答案和解析>>
科目: 来源: 题型:
A.不易生锈 B.导电性好 C.密度小 D.强度高
查看答案和解析>>
科目: 来源: 题型:
(1)写出刚好出现沉淀的总物质的量为最大值时的离子方程式(用一个式子表示):__________。
(2)随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。
写出B点和C点对应的Ba(OH)2溶液体积:B. _______________,C._______________。
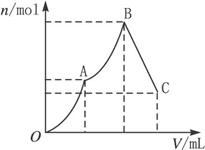
查看答案和解析>>
科目: 来源: 题型:
反应后得到的FeCl3溶液呈棕黄色。用此溶液进行以下实验:
(1)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为__________________,此反应属于_________反应。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈_________色,即可制得Fe(OH)3胶体。
(3)取另一小烧杯也加入20 mL蒸馏水后,向烧杯中加入1 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处:分别用激光笔照射烧杯中的液体,可以看到_________烧杯中的液体会产生丁达尔效应。这个实验可用来区别_________。
(4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可看到溶液红褐色逐渐变浅,最终又得到黄色的FeCl3溶液,发生此变化的化学方程式为____
_________________________,此反应也属于________________反应。
查看答案和解析>>
科目: 来源: 题型:
(1)配平上述反应的化学方程式:
______KClO3+______HCl====______KCl+______Cl2↑+______H2O
(2)浓盐酸在反应中显示出来的性质是______。(填写编号,多选倒扣分)
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)若产生0.1 mol Cl2,则转移电子的物质的量为 ______mol。
(4)若反应中HCl的利用率只有50%,当氧化产物比还原产物多7.1 g时,则浓盐酸的物质的量浓度为_____________。
查看答案和解析>>
科目: 来源: 题型:
甲___________,乙___________,丙___________,丁___________,戊___________。
查看答案和解析>>
科目: 来源: 题型:
A.盐析 B.过滤 C.结晶 D.渗析
在下列横线上用上面方法的编号填出恰当的分离或提纯方法。
(1)除去Ca(OH)2溶液中悬浮的CaCO3,用___________;
(2)除去蛋白质胶体中混有的(NH4)2SO4,用___________;
(3)分离KNO3和NaCl的固体混合物,用___________;
(4)分离油脂皂化反应的产物(甘油和肥皂),用___________。
查看答案和解析>>
科目: 来源: 题型:
A.在含大量Fe3+的溶液中:![]() 、Na+、Cl-、SCN-
、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、![]() 、
、![]()
C.在c(H+)=10-13 mol·L-1的溶液中:![]() 、Al3+、
、Al3+、![]() 、
、![]()
D.在pH=1的溶液中:K+、Fe2+、Cl-、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com