
科目: 来源: 题型:
A.铜锌原电池中铜为负极,发生氧化反应
B.用电解法精炼粗铜时,粗铜作阴极
C.在镀件上电镀铜时,可用精铜作阳极
D.电解稀H2SO4制H2、O2时,可用铜作阳极?
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
A.利用电池外壳的材料
B.不使电池中渗泄的电解质腐蚀其他物品
C.防止电池中汞、镉、铅等重金属离子对土壤和水源的污染
D.回收其中的石墨电极
查看答案和解析>>
科目: 来源: 题型:
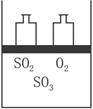
(1)在该平衡状态时n(SO3)=________;
(2)若起始时加入1.2 mol SO2、0.6 mol O2和x mol SO3,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的取值为________________;
(3)若反应开始时的v(逆)>v(正),达到上述平衡状态时,气体的总物质的量仍为4.2 mol。则起始时n(SO3)的取值范围是________________。
查看答案和解析>>
科目: 来源: 题型:
2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0
2SO3(g);ΔH<0
(1)写出该反应的化学平衡常数表达式K=________。
(2)降低温度,该反应K值________,二氧化硫转化率________,化学反应速率________ (以上均填“增大”“减小”或“?不变”)。
(3)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如下图,反应处于平衡状态的时间是________。
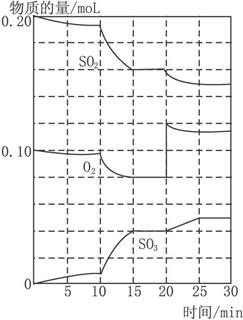
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是________ (用文字表达)。
10 min到15 min的曲线变化的原因可能是________ (填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
查看答案和解析>>
科目: 来源: 题型:
(1)若用v(H2O)表示该反应前20 s内平均速率,则v(H2O)=。
(2)若在上述平衡混合物中加入少量Na2O固体,并在此温度下再次达到新的平衡(第二平衡),则平衡时H2的物质的量________(填“增大”“减小”或“不变”)。理由是_____________。
(3)若向上述第一平衡的混合物中再充入a mol H2(a<0.12),在相同条件下达到新的平衡(第三平衡),此时CO的物质的量n的取值范围是___________________ 。
查看答案和解析>>
科目: 来源: 题型:
(1)此时混合气体的平均相对分子质量为________,CO的转化率为________。
(2)保持温度、体积不变,再向容器中通入0.02 mol H2O(g),建立新平衡,c(H2)平衡=________,混合气体的平均相对分子质量为________,CO的转化率为________。
(3)其他条件不变,当温度升高时,CO的转化率________;当容器被压缩至0.5 L时,H2的体积分数相对原平衡________ (填“升高”“降低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
(1)从开始反应至反应达到平衡状态,生成C的平均反应速率为________。
(2)x=________。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡________ (填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入a mol C,在t ℃时达到新的平衡,此时B的物质的量为n(B)= ________mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为_______。
查看答案和解析>>
科目: 来源: 题型:
NH3+H2O![]() NH3·H2O
NH3·H2O![]()
![]() +OH-;ΔH>0
+OH-;ΔH>0
在下列情况下,NH3、![]() 、OH-的浓度如何变化?
、OH-的浓度如何变化?
(1)加入NH4Cl晶体:c(OH-)___________,?c(![]() )___________。
)___________。
(2)加入HCl:c(NH3) ___________,?c(OH-)___________。
(3)加入少量NaOH晶体:c(NH3) ___________,c(![]() )___________。
)___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com