
科目: 来源: 题型:
A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量
B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量
C.反应物H2和O2所具有的总能量等于生成物H2O所具有的总能量
D.反应物H2和O2具有的能量相等
查看答案和解析>>
科目: 来源: 题型:
A.在稀溶液中所有酸和碱反应的中和热都相等
B.在稀溶液中强酸和强碱反应的中和热都相等
C.在稀溶液中1 mol酸和1 mol碱反应放出的热量都相等
D.将浓硫酸滴入氢氧化钠溶液中刚好生成1 mol水时,产生的热量即为中和热
查看答案和解析>>
科目: 来源: 题型:
①元素的种类 ②原子的种类 ③分子数目 ④原子数目 ⑤反应前物质的质量总和与反应后物质的质量总和 ⑥如果在水溶液中反应,则反应前与反应后阳离子所带的正电荷总数 ⑦反应前反应物的总能量与反应后生成物的总能量
A.①②③④ B.①②⑤⑥
C.①②④⑤ D.②③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
A.-183 kJ·mol-1 B.183 kJ·mol-1
C.-862 kJ·mol-1 D.862 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试回答下列问题。
(1)实验时用环形玻璃棒搅拌溶液的方法是___________,不能用铜丝搅拌棒代替环形玻璃棒的理由是____________________________________________________________________。

(2)经数据处理,t2-t1=3.4 ℃。则该实验测得的中和热ΔH=_______〔盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c按4.18 J·g-1·℃-1计算)〕。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1_______ΔH(填“<”“>”或“=”),理由是 ________________________________。
查看答案和解析>>
科目: 来源: 题型:
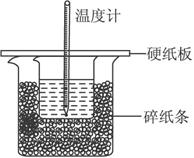
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________。
(2)烧杯间填满碎纸条的作用是 _________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”“不相等”),所求中和热_________ (填“相等”“不相等”),简述理由:_____________________________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_________;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会_________。(均填“偏大”“偏小”“无影响”)
查看答案和解析>>
科目: 来源: 题型:
A.吸热反应在一定条件下可以发生
B.需要加热才能发生的反应一定是吸热反应
C.反应是吸热反应还是放热反应必须看反应物和生成物所具有的总能量的相对大小
D.放热反应在常温下一定很易发生
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
(1)“参加化学反应的物质的总质量一定等于生成物的总质量,即质量守恒定律。”
判断________。解释:__________________________ 。
(2)“在化学反应中,反应物的总能量一定等于生成物的总能量,即能量守恒定律。”
判断________。解释:__________________________ 。
(3)“在氧化还原反应中,氧化剂得电子总数一定等于还原剂失电子总数即电子守恒。”
判断________。解释:__________________________ 。
查看答案和解析>>
科目: 来源: 题型:
N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH2=-534 kJ·mol-1 ②
请计算1 mol气体肼和NO2完全反应时放出的热量为__________________。写出肼与NO2反应的热化学方程式:________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com