
科目: 来源: 题型:
工业上制备金属铝,采用电解熔融Al2O3(加冰晶石),不电解熔融AlCl3,而工业上制备金属镁则采用电解熔融的MgCl2,而不电解MgO,其原因是_____________________。
查看答案和解析>>
科目: 来源: 题型:
A.范德华力 B.共价键 C.氢键 D.相对分子质量
查看答案和解析>>
科目: 来源: 题型:
A.自由电子吸收可见光后又迅速地释放,使金属具有金属光泽
B.金属的导电性是由金属阳离子和自由电子的定向运动体现的
C.金属键的强弱与金属阳离子的半径及其价电子数有关
D.金属的导热性和导电性都是通过自由电子的定向运动完成的
查看答案和解析>>
科目: 来源: 题型:
A.构成单质分子的粒子一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定是极性键
查看答案和解析>>
科目: 来源: 题型:
A.离子键是由阴、阳离子通过静电作用达到平衡时形成的
B.只有金属和非金属化合才能形成离子键
C.凡是含有离子键的化合物一定含有金属元素
D.含有离子键的化合物一定是离子化合物
查看答案和解析>>
科目: 来源: 题型:
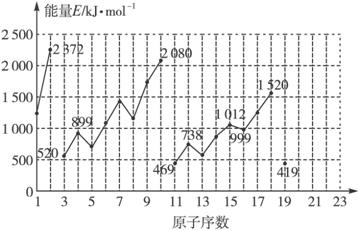
试根据元素在周期表中的位置,分析图中曲线的变化特点,并完成下列问题:
(1)同主族内不同元素的E值变化的特点是____________________________,各主族中的E值的这种变化特点体现了元素性质的________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象,试预测下列关系中正确的是________(填写编号)。
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:________<E<________。
(4)10号元素E值较大的原因是_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
单质 | A | B | C | D | E | F | G | H | I | J |
熔点/℃ | -150 | 550 | 160 | 210 | -50 | 370 | 450 | 300 | 260 | 250 |
与水反应 |
| √ |
|
|
| √ | √ | √ |
|
|
与酸反应 |
| √ |
| √ |
| √ | √ | √ |
| √ |
与氧气反应 |
| √ | √ | √ | √ | √ | √ | √ | √ | √ |
不发生化学反应 | √ |
|
|
| √ |
|
|
|
|
|
相对于A元素的原子质量 | 1.0 | 8.0 | 15.6 | 17.1 | 23.8 | 31.8 | 20.0 | 29.6 | 3.9 | 18.0 |
按照元素性质的周期递变规律,试确定以上十种元素的相对位置,并填入下表:

查看答案和解析>>
科目: 来源: 题型:
①均为周期表中前20号元素,A、B在同一主族,C、D在同一周期;
②相互间可组成B2C2、A2C、D C2等化合物;
③B的阳离子与C的阴离子核外电子排布相同;
④B2C2同A2C或者D C2反应都生成气体C2,B单质与A2C反应生成气体A2,气体A2与C2按照体积比2∶1混合,点火爆炸,完全化合成常温下无色、无味的液体A2C,请完成下面的问题。
(1)写出四种元素的符号:A_________;B_________;C_________;D_________。
(2)BCA的电子式为_________,其化学键的类型为__________________。
(3)B2C2与DC2反应的化学方程式为____________________________________________。
(4)B2C2与A2C的反应的化学方程式为__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com