
科目: 来源: 题型:

回答下列问题:
(1)混合物中是否存在FeCl2_______________(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4____________(填“是”或“否”)。
(3)写出反应④的离子反应式:____________________________________。
(4)请根据计算判断混合物中是否含有AlCl3(简述你的计算依据和计算结果,不要求写完整计算过程)。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(一)甲组:
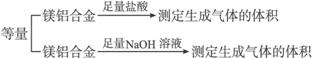
实验方案:镁铝合金![]() 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量用托盘天平称量
②溶解把①中药品加入烧杯中,用规格为___________mL的量筒量取一定体积1 mol·L-1 NaOH 溶液加入烧杯中,不断搅拌,充分反应
③过滤
④洗涤若未对过滤所得固体进行洗涤,测得铝的质量分数将__________(填“偏高”“偏低”或“不变”),证明固体已洗涤干净的方法为________________________________________。
⑤干燥、称量剩余固体
(二)乙组:
实验方案:
实验装置:
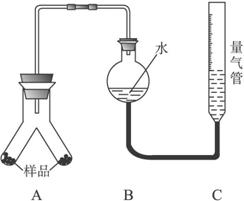
实验步骤:
①按上图连接好装置。
②称取两份质量均为
③通过注射器的针头向装置A左侧管中注入足量的稀盐酸,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为448 mL。
④通过另一针头向装置A右侧管中加入足量的稀NaOH溶液,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为672 mL。
问题和讨论:
(1)上述实验步骤①和②之间必须加一步________的操作,具体方法为__________________。
(2)为使气体体积测定结果不至于引起很大偏差,除了应注意使B和C中的液面相平外,在反应完全后至读数之前,还需要注意的关键问题是(只需写出一点)_________________。
(3)计算合金中铝的质量分数时,是否需要将气体体积折算为标准状况的体积。
查看答案和解析>>
科目: 来源: 题型:

已知:
Ⅰ.![]() (X表示卤素原子,下同)
(X表示卤素原子,下同)
Ⅱ.![]()
Ⅲ.当有一个取代基的一取代苯继续发生取代反应时,新引进的取代基受到原取代基的影响而可以取代邻位、对位或间位。
使新的取代基进入它的邻位、对位的取代基有:—CH3、—NH2、—X等;
使新的取代基进入它的间位的取代基有:—COOH、—NO2等。
请结合上述所给3条信息,回答问题:
(1)②、③两步反应顺序是否可以颠倒_____________。
(2)反应②的化学反应方程式:_________________________________________________。
(3)请你设计D→E(C3H6O2)的合成路线。
要求:①合成过程中无机试剂任选、有机原料碳原子不超过2个;②合成反应流程图表示方法示例如下:A![]() C……
C……![]() D
D
查看答案和解析>>
科目: 来源: 题型:
(1)上述两种相对分子质量相等的18电子化合物在水溶液中相互反应,生成一种固体单质。写出有关化学方程式:__________________________________________________________
_____________________________________________________________________。
(2)WU3在NaClO溶液中生成W2U4,写出有关离子方程式___________________________
_____________________________________________________________________。
(3)U2X2和W2U4常温下均是无色液体,相互反应生成两种气体产物,均是大气成分。在p kPa、t ℃时测得每生成
____________________________________________________________________。
(4)两粒子的原子总数相等、最外层电子总数也相等,它们属于等电子体,人们发现等电子体的空间构型相同,物理性质相似。已知CO2和N2O属于等电子体,则与VW-互为等电子体的是(任写一种)__________。
查看答案和解析>>
科目: 来源: 题型:
A.Na2CO3溶液中,![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol·L-1
C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(![]() )大小顺序①>②>③
)大小顺序①>②>③
D.10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20 mL
查看答案和解析>>
科目: 来源: 题型:
A.新平衡体系中,SO2和O2物质的量之比仍为2:1
B.平衡向正反应方向移动了,原因是正反应速率增大了,逆反应速率减小了
C.新平衡体系与旧平衡体系比较,SO3的浓度肯定增大了
D.若所采取的措施是缩小容器的容积,则新平衡SO2和O2转化率之比和旧平衡中SO2和O2的转化率之比都是1:1
查看答案和解析>>
科目: 来源: 题型:
A.所有碳原子可能在同一平面上 B.所有碳原子可能在同一条直线上
C.所有原子可能在同一平面上 D.所有氢原子可能在同一平面上
查看答案和解析>>
科目: 来源: 题型:

A.电解过程中,铜电极上有H2产生
B.不可能发生反应:Cu+H2SO4![]() CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
查看答案和解析>>
科目: 来源: 题型:
A.含有大量S2-的溶液:ClO-、Na+、Cl-、![]()
B.无色澄清溶液:![]() 、
、![]() 、K+、Fe3+
、K+、Fe3+
C.能使pH试纸变红的溶液:![]() 、Na+、
、Na+、![]() 、Fe3+
、Fe3+
D.水电离产生的c(H+)=1×10-12 mol·L-1的溶液:![]() 、
、![]() 、Cl-、Ca2+
、Cl-、Ca2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com