
科目: 来源: 题型:
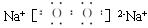
试回答:
(1)C元素的名称为_______________;
丁的结构式为__________;
戊的电子式为__________。
(2)用电离方程式解释:
乙溶液显酸性的原因是_________________________。
(3)写出有关反应的离子方程式:
①B单质+NaOH溶液:____________________________________________________
②己溶液+丙溶液→白色沉淀+丁:____________________________。
查看答案和解析>>
科目: 来源: 题型:
Br2(g)+H2(g) ![]() 2HBr(g);ΔH<0。30 s后达到平衡,其中HBr的体积分数φ(HBr)随时间变化如下图曲线(Ⅱ)所示。
2HBr(g);ΔH<0。30 s后达到平衡,其中HBr的体积分数φ(HBr)随时间变化如下图曲线(Ⅱ)所示。
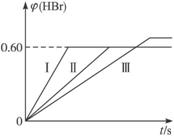
(1)达平衡时,用Br2(g)表示的化学反应速率是_____________。
(2)若改变反应条件,在甲条件下φ(HBr)的变化如图中曲线(Ⅰ)所示,在乙条件下φ(HBr)的变化如图中曲线(Ⅲ)所示,则甲条件可能是(填入下列条件的序号,下同)___________,乙条件可能是___________。
A.恒温条件下,缩小反应容器体积
B.恒温条件下,扩大反应容器体积
C.恒容条件下,升高温度
D.恒容条件下,降低温度
E.恒温、恒容条件下,加入适当催化剂
F.恒温、恒容时充入氩气
(3)若保持温度不变,在另一相同的
查看答案和解析>>
科目: 来源: 题型:阅读理解

请回答:
(1)装置A中发生反应的化学方程式为_______________。
(2)装置D中试管中放置的棉花中应浸一种液体,这种液体是__________,其作用是__________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是__________。B中应放置的液体是__________(填选项序号)。
a.水 b.酸性KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,他们取
①有一定量的余酸但未能与铜片完全反应,你认为原因是__________。
②下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是__________(填选项序号)。
a.Fe粉 b.BaCl2溶液 c.Ag粉 d.NaHCO3溶液
(5)为定量测定余酸的物质的量浓度,某同学进行了如下设计:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。而测定SO2的量的方法有多种,你认为下列实验方案中可行的是________(填选项序号)。
a.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
b.将装置A产生的气体缓缓通入足量的用硫酸酸化的KMnO4溶液,再加入BaCl2溶液,过滤、洗涤、干燥、称量沉淀
c.用排水法测定装置A产生气体的体积(已折算成标准状况)
d.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
查看答案和解析>>
科目: 来源: 题型:
A.氯水或浓硝酸应存在配有磨口玻璃塞的棕色试剂瓶中
B.碱式滴定管中装满标准NaOH溶液后,尖嘴部分若有气泡,赶走气泡的方法是:用手将下端胶管弯曲,使尖嘴部分向上倾斜,然后挤压玻璃珠,快速放液至赶走气泡为止
C.用pH试纸检测溶液的酸性的操作是:先取一条试纸放在表面皿上,用干燥洁净的玻璃棒蘸取待测液点在试纸的中部,30 s内观察颜色的变化并与标准比色卡比较,确定溶液的pH
D.用25 mL量筒量取3.0 mL浓硫酸
E.液态氯乙烷试样加入稀NaOH溶液煮沸,然后再加入硝酸银溶液检验氯元素
F.在2 mL 10%NaOH溶液中滴加2% CuSO4溶液4—6滴,振荡后加入乙醛溶液0.5 mL,加热至沸腾,则有红色沉淀生成
查看答案和解析>>
科目: 来源: 题型:
有机物 | 乙烯 | 乙炔 | 环己烷 | 苯 |
Ω | 1 | 2 | 1 | 4 |
据此下列说法不正确的是
A.1 mol Ω=3的不饱和链烃再结合6 mol H,即达到饱和
B.![]()
C.C4H8的不饱和度与C3H6、C2H4的不饱和度不一定相同
D.CH3CH2CH=CH2与环丁烷(![]() )的不饱和度相同
)的不饱和度相同
查看答案和解析>>
科目: 来源: 题型:
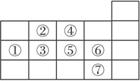
A.原子半径的大小顺序是:①>②>③>④
B.氢化物的沸点:⑤高于④
C.最高价氧化物对应水化物的酸性:②比③强
D.氢化物的稳定性:⑦比⑥强
查看答案和解析>>
科目: 来源: 题型:
A.c(Na+)+c(H+)![]() c(A-)+c(OH-)
c(A-)+c(OH-)
B.c(A-)+c(HA)![]()
C.若混合液呈酸性,则c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
D.若混合液呈碱性,则c(Na+)>c(HA)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
| A | B | C | D |
阳极 | 蓝 | 白 | 红 | 蓝 |
阴极 | 白 | 蓝 | 蓝 | 蓝 |
查看答案和解析>>
科目: 来源: 题型:
A.正极发生氧化反应
B.负极反应式为Fe-3e-![]() Fe3+
Fe3+
C.能实现该反应的原电池是:正极为Cu,负极为Fe,电解质溶液为Fe2(SO4)3溶液
D.能实现该反应的原电池是:正极为Fe,负极为Zn,电解质溶液为FeCl3溶液
查看答案和解析>>
科目: 来源: 题型:
A.无色溶液中:[Ag(NH3)2] +、K+、H+、![]()
B.使甲基橙变红的溶液中:Al3+、Cl-、Fe2+、![]()
C.常温下,pH=12的溶液中:![]() 、Cl-、K+、
、Cl-、K+、![]()
D.含有较多Fe3+的溶液中:Na+、![]() 、SCN-、I-
、SCN-、I-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com