
科目: 来源: 题型:
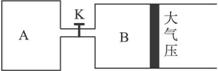
(1)设A、B两容器中化学平衡常数分别为K1和K2,则它们的大小关系是K1_________K2(填“大于”“等于”或“小于”)。
(2)B中X的转化率α(X)B为____________。
(3)A中Z和B中的W物质的量的比较:n(Z)A________n(W)B(填“大于”“等于”或“小于”)。
(4)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为__________ L(用含a的代数式表示,连通管中气体体积不计);在温度不变的情况下,要使B容器恢复原来反应前的体积,可采取的措施是_________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)钒在元素周期表位于第_________周期,第_________族。
(2)钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的化学式为K2H6U2V2O15(其中钒元素的化合价为+5)。若用氧化物的形式表示,该化合物的化学式为___________。
(3)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成![]() ,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应的化学方程式:
,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应的化学方程式:
_______![]() +________H
+________H![]() _______VO++_______CO2+________H2O
_______VO++_______CO2+________H2O
其中还原剂是_________;若反应消耗
(4)工业上由V2O5冶炼金属钒常用铝热剂法。试用化学方程式表示出来_____________。
查看答案和解析>>
科目: 来源: 题型:
【查阅部分资料】草酸铵〔(NH4)2C2O4〕属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。

试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是____________________________________________________。
(2)写出检验Ca2+的离子方程式________________________________________________。
(3)写出沉淀C所含主要物质的化学式____________。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式______________________________。
(5)步骤⑨的作用是_________________,猜测步骤⑩的目的是______________________。
查看答案和解析>>
科目: 来源: 题型:


装置Ⅰ 装置Ⅱ
请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为____________________________________________。
(2)乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是________________________________________________。于是他设计装置Ⅱ,其中装铜片的是气球。
(3)如何检验装置Ⅱ的气密性?
(4)化学研究性学习小组的其他同学对上述实验进行了研究,认为装置Ⅱ虽然作了改进,但如果按装置Ⅱ进行实验,还是会出现三个问题,需要作相应改进措施。请你帮助他们填写相关内容。
问题一:______________________________________________________________。
措施:加热或______________。
问题二:试管中的气体是淡棕红色,而不是无色。
措施:____________(填具体操作,不能增加装置)。
问题三:______________________________________________________________。
措施:________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:

(1)高温灼烧碳酸钡和碳酸钙的混合物,直至完全分解。所需仪器除坩埚、泥三角、玻璃棒、三脚架外还有_____________、_____________。
(2)将灼烧后的固体混合物置于
(3)将“(2)”中滤液_____________并过滤,得到的Ba(OH)2固体溶于水制成溶液。
(4)向制得的Ba(OH)2溶液中滴加酚酞试剂,再通入二氧化碳,当观察到_____________________时,即可停止通二氧化碳。
(5)滤出碳酸钡沉淀,经_______________后即得到纯净的碳酸钡。
查看答案和解析>>
科目: 来源: 题型:
A.Fe(NO3)3溶液![]() 白色沉淀
白色沉淀
B.Ba(NO3)2溶液![]() 白色沉淀
白色沉淀
C.无色溶液![]() 白色沉淀
白色沉淀
D.无色溶液![]() 无色溶液
无色溶液![]() 白色沉淀
白色沉淀
查看答案和解析>>
科目: 来源: 题型:
A.原混合溶液中c(K+)为2 mol·L-1 B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
A.pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
B.pH>7,c(Na+)>c(A-)>c(OH-)>c(H+)
C.pH>7,c(Na+)>c(OH-)>c(A-)>c(H+)
D.pH<7,c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
A.Fe3O4与稀硝酸反应:Fe3O4+8H+![]() Fe2++2Fe3++4H2O
Fe2++2Fe3++4H2O
B.向硝酸银溶液中逐滴滴入稀氨水直至过量:Ag++2NH3·H2O![]() [Ag(NH3)2]++2H2O
[Ag(NH3)2]++2H2O
C.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2![]() +2OH-
+2OH-![]() CaCO3↓+
CaCO3↓+![]() +2H2O
+2H2O
D.Na2S溶液呈碱性:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目: 来源: 题型:
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则起始时A、B的物质的量之比为a∶b
C.若平衡体系中共有气体m mol,再向其中充入n mol B,达到平衡时气体总物质的量为(m+n) mol,则a+b=c+d
D.若a+b=c+d,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com