
科目: 来源: 题型:
①R—CH2Cl+NaOH![]() R—CH2OH+NaCl
R—CH2OH+NaCl

为了合成该物,某实验室的科技人员设计了下列合成路线:

试回答下列问题:
(1)试写出:A的名称__________;D的结构简式__________。
(2)反应④的一般条件是___________________。
(3)上述合成路线中属于取代反应的是__________ (填编号)。
(4)反应①的化学方程式为______________________________。
查看答案和解析>>
科目: 来源: 题型:
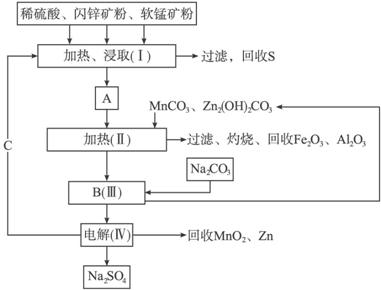
已知①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②Ⅳ中的电解反应式为MnSO4+ZnSO4+2H2O![]() MnO2+ Zn+2H2SO4。
MnO2+ Zn+2H2SO4。
(1)A中属于还原产物的是__________。
(2)MnCO3、Zn2(OH)2CO3的作用是____________________________________;Ⅱ需要加热的原因是____________________________________;C的化学式是____________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是____________。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是____________。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、____________、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是____________。
查看答案和解析>>
科目: 来源: 题型:
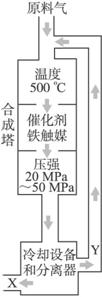
①X的化学式为______________;
②上图中条件选定的主要原因是(选填字母序号)__________;
A.升高温度、增大压强均有利于氨的合成
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
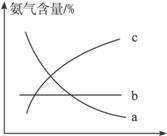
③改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号)___________,当横坐标为温度时,变化趋势正确的是(选填字母序号)______________。
(2)常温下氨气极易溶于水,其水溶液可以导电。
④用方程式表示氨气溶于水且显弱碱性的过程:____________________________________;
⑤氨水中水电离出的c(OH-)_________10-7 mol·L-1(填写“>”“<”或“=”);
⑥将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为____________。
查看答案和解析>>
科目: 来源: 题型:

(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?___________(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?___________区间(若正确,此问不答)。
(2)关于该滴定实验,从下列选项中选出最恰当的一项___________。(选填字母)

| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
A | 碱 | 酸 | 石蕊 | (乙) |
B | 酸 | 碱 | 甲基橙 | (甲) |
C | 碱 | 酸 | 酚酞 | (甲) |
D | 酸 | 碱 | 酚酞 | (乙) |
(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是________。
A.c(OH-)一定大于c(CH3COO-) B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-) D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)___________2c(Na+)。(填“>”“<”或“=”)
Ⅱ.t ℃时,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13:
(5)该温度下水的离子积常数KW的数值为___________。
(6)该温度下(t ℃),将100 mL 0.1 mol·L-1的稀硫酸溶液与100 mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___________。
查看答案和解析>>
科目: 来源: 题型:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为_________________________________________________________________。
某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸。请在方格中画出该装置:

(2)在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9 mol,则该硫酸的实际体积____________(填“>”“=”或“<”)100 mL。
有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?__________(填“可行”或“不可行”)。
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗?____________(填“同意”或“不同意”),原因是_____________________________________________________。
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,请简述实验方案、实验现象及由此得出的结论:______________________________。
查看答案和解析>>
科目: 来源: 题型:
a.微碱性条件下用Fe2+还原,还原产物为NH3。
b.pH=10.25时,用铝粉还原,![]() 的还原产物主要为N2。
的还原产物主要为N2。
c.在催化剂作用下用氢气还原,还原产物主要为N2。
(1)a方案中的一种产物还有净水作用,这种物质是______________。(请填写化学式)
(2)b方案中最好用________调节pH。
A.NaOH B.CaO C.NH3·H2O
理由是_____________________________________________________________。
(3)与a、b方案相比,c方案的优点是___________________________________________。
查看答案和解析>>
科目: 来源: 题型:

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有___________、___________(填仪器名称),操作Ⅱ必须用到的仪器是___________(填编号)。
A.50 mL烧杯 B.50 mL量筒 C.100 mL量筒 D.25 mL滴定管
(2)请写出加入溴水发生的离子反应方程式________________________,加入氨水要过量的原因是________________________。
(3)检验沉淀是否已经洗涤干净的操作是_________________________________________。
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b
(5)若蒸发皿质量是W
查看答案和解析>>
科目: 来源: 题型:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验室方案Ⅱ更便于实施
查看答案和解析>>
科目: 来源: 题型:
A.c(Na+)=c(HA-)+
B.c(H
C.c(H+)·c(OH-)=10-14
D.c(A2-)+c(OH-)=c(H+)+c(H
查看答案和解析>>
科目: 来源: 题型:
A.用待测液润洗滴定用的锥形瓶
B.配制FeCl3溶液时,将FeCl3固体溶于盐酸中,然后再用水稀释到所需的浓度
C.用10 mL的量筒量取4.80 mL的浓硫酸
D.不慎接触过多的氨,及时吸入新鲜的空气和水蒸气,并用大量水冲洗眼睛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com