
科目: 来源: 题型:
A.催化转化器中的铂催化剂可加快CO的氧化
B.铂表面做成蜂窝状更有利于提高催化效果
C.在铂催化下,NO、NO2可被CO还原成N2
D.使用铂催化剂,可以提高CO、NO、NO2的转化率
查看答案和解析>>
科目: 来源: 题型:阅读理解
1.《有机化学基础》
M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,可用于制头盔、防弹背心和刚性前后防护板。下图是有关M5纤维等有机物的转化关系图(部分反应未注明条件):
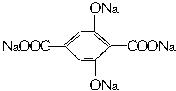
请回答:
(1)写出下列物质的结构简式F____________,H____________。B的氢的核磁共振谱图中有____________种类型的氢原子吸收峰。
(2)1 mol G与Na2CO3溶液反应,最多消耗Na2CO3____________ mol。
(3)指出下列反应的反应类型:A→B____________;G→M5____________。
(4)写出C→D反应的化学方程式:____________________________________________。
(5)试分析M5纤维具有极高强度的原因:_______________________________________。
2.《物质结构与性质》
有A、B、C、D、E原子序数均为前20号的五种元素,其中A元素和B元素的原子都有1个未成对电子,A+与B-具有相同的电子层结构,B原子得一个电子后2p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于其中子数。R是由A、D两元素形成的化合物;E元素原子中4s能级有2个电子。请回答:
(1)A单质、B单质、化合物R的熔点大小顺序为____________(填序号)。
①A单质>B单质>化合物R ②化合物R>A单质>B单质
③A单质>化合物R>B单质 ④B单质>化合物R>A单质
(2)B-的特征电子排布式为____________;在CB3分子中C元素原子的原子轨道发生的是____________杂化,其固态时的晶体类型为____________。
(3)C的氢化物的空间构型为____________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是____________________________________________________________________。
(4)B、C、D三元素的电负性大小顺序为____________>____________>____________(填元素符号)。
(5)E与B形成的晶体M的最小单元“晶胞”如下图所示,则M的化学式为____________;如果M晶体的密度为d g·cm-3,阿伏加德罗常数为NA,则晶体中两个距离最近的E中心间的距离为____________ cm。
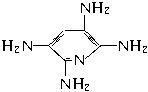
查看答案和解析>>
科目: 来源: 题型:


 ,根据下图回答下列问题(图中A、B、C、D、E各代表一种有机物):
,根据下图回答下列问题(图中A、B、C、D、E各代表一种有机物):

(1)C的结构简式为____________;D中官能团的名称是____________。
(2)已知A中只含C、H、O三种元素,其质量比为60∶5∶16;A的蒸气密度是同温同压下H2密度的81倍,则A的分子式为____________。
(3)在电脑芯片生产中,高分子光阻剂是光刻蚀0.11μm线宽芯片的关键物质。E是生产这种高分子光阻剂的主要原料。E具有如下特点:①羟基直接与苯环相连;②苯环上的一氯取代物只有两种;③能发生加聚反应。E的结构简式为____________,E在一定条件下发生加聚反应的化学方程式为____________________________________。
(4)芳香族化合物F与C具有相同官能团,与E互为同分异构体,请写出F的各种可能的结构简式______________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解

反应体系中各组分的部分性质见下表:
气体 | 氮气 | 氢气 | 氨 |
熔点/℃ | -210.01 | -252.77 | -77.74 |
沸点/℃ | -195.79 | -259.23 | -33.42 |
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程,即反应后通过把混合气体的温度降低到____________,使混合气体分离出产品,N2、H2继续循环。写出该反应的化学平衡常数表达式:K=____________。
(2)运用化学反应速率和化学平衡的观点说明工业上采用“使混合气体分离出产品,N2、H2继续循环”的生产措施的理由:___________________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_____________________________。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图甲所示。下列叙述正确的是____________。
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图甲所示。下列叙述正确的是____________。
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值大
(5)1998年希腊亚里斯多德大学的Marncellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如下图乙。阴极的电极反应式为__________________________________________________________________。


甲 乙
查看答案和解析>>
科目: 来源: 题型:
H![]() HA-+H+ K1=4.50×10
HA-+H+ K1=4.50×10![]() A2-+H+ K2=4.70×10-11
A2-+H+ K2=4.70×10-11
用0.300 mol·L-1盐酸滴定含有Na
加入的盐酸/mL | 1.00 | 10.00 | 28.00 |
pH | 10.33 | 8.34 | 6.35 |
(1)加入1.00 mL盐酸时首先与HCl反应的溶质是________,含A的产物是__________。
(2)(1)中生成的含A的产物有____________ mol。
(3)写出(1)中生成的产物与溶剂反应的离子方程式:____________________________。
(4)当pH=8.34时反应混合物有两种溶质,而pH=6.35时反应混合物只有一种含钠化合物溶质,试计算起始溶液中存在的Na
查看答案和解析>>
科目: 来源: 题型:

(1)操作1与操作2的顺序能否调换?___________(填“能”或“否”),理由是___________
___________________________________。
(2)常温下,CaCO3和CaSO4的溶解度分别为1.5×10
(3)判断操作2通入的是“适量CO2”的简单实验方法是_____________________________。
(4)从绿色化学角度考虑,该工艺流程应增加一个操作,这个操作是_________________。
(5)豆腐是日常食品之一,它的制作过程中使用了石膏或盐卤,其中包含的化学原理是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
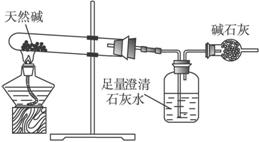
装置Ⅰ
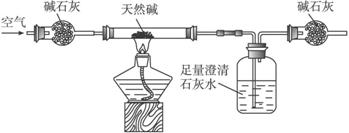
装置Ⅱ
(1)按照上述实验过程,该化学兴趣小组至少使用________次天平。
(2)将天然碱样品加热,冷却至室温,称量其质量为b
(3)你认为选择____________(填“装置Ⅰ”或“装置Ⅱ”)进行实验为佳。选择的理由是___________________________________________________________________。
(4)有一学生在加热过程中对剩余固体进行多次称重(处理数据时已经减去仪器质量),并描出如下图的曲线;
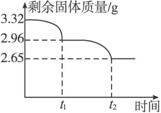
①写出t1→t2反应的化学方程式:________________________________________________。
②通过上述曲线确定天然碱样品的化学式:________________________________________。
查看答案和解析>>
科目: 来源: 题型:

(1)写出废铁屑与盐酸反应的离子方程式:
①__________________________________;____________________________________。
(2)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
编号 | 实验内容 | 实验操作 | 预期现象和结论 |
① | 检验黄色溶液A中是否含有Fe2+ |
|
|
② | 检验绿色溶液C中是否含有Fe3+ |
|
|
(3)电解时阴极材料是____________。
(4)采用排液法收集氯气,该液体是____________。
查看答案和解析>>
科目: 来源: 题型:
[探究活动一]探究金属与不同酸反应的反应速率:常温下,用经过砂纸打磨的铝片中取两片质量相等、表面积相同的铝片,分别加入到盛有体积相同、c(H+)相同,足量的稀硫酸和稀盐酸溶液的两支试管中,发现铝片在稀盐酸中消失的时间比在稀硫酸中短。
[探究活动二]探究影响稀硫酸与某金属反应速率的因素。下表是某研究性学习小组探究稀硫酸与某金属反应的实验数据:
实验序号 | 金属质量/g | 金属状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/s | |
反应前 | 反应后 | ||||||
1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
3 | 0.10 | 丝 | 0.7 | 50 | 20 | 46 | 250 |
4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
9 | 0.10 | 丝 | 1.1 | 50 | 35 | 51 | 40 |
请回答:
(1)对[探究活动一]实验现象发生的原因,请你帮该研究性学习小组提出两个假设:
假设Ⅰ_______________________________________________________________。
假设Ⅱ_______________________________________________________________。
并请你设计实验对以上假设进行验证:
验证假设Ⅰ____________________________________________________________。
验证假设Ⅱ____________________________________________________________。
(2)分析[探究活动二]的实验数据可发现有一个数据明显有错误,该数据是实验_________(填实验序号)的____________,理由是__________________________________________。
(3)分析[探究活动二]的实验数据可得出的结论是_______________________________。
查看答案和解析>>
科目: 来源: 题型:

| 甲 | 乙 | 丙 | 试管中的现象 |
A | 浓盐酸 | 二氧化锰 | 石蕊溶液 | 先变红后褪色 |
B | 醋酸 | 粉状贝壳 | Na2SiO3溶液 | 无浑浊 |
C | 浓氨水 | 生石灰 | AgNO3溶液 | 无明显现象 |
D | 浓硝酸 | 铜 | 水 | 生成无色气体并在?试管口变为红棕色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com