
科目: 来源: 题型:
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物 ⑤Y2+具有还原性 ⑥Y3+的氧化性比X2+的氧化性强
A.①③⑤⑥ B.①③④ C.②④⑥ D.②⑤
查看答案和解析>>
科目: 来源: 题型:
A.控制塑料购物袋的使用主要是为了节约成本
B.使用可降解塑料袋有利于减少“白色污染”
C.聚氯乙烯塑料袋可用来长时间存放食品
D.塑料购物袋具有热固性,不能回收利用
查看答案和解析>>
科目: 来源: 题型:阅读理解
1.已知次溴酸(HBrO)的结构简式为HO—Br,如图乙烯跟溴水中各成分反应既可生成A,同时又可生成B和C2H5Br。

回答下列问题:
(1)环氧乙烷![]() 的结构可简写为
的结构可简写为![]() ,则E的化学式是__________。
,则E的化学式是__________。
(2)A的结构简式是__________;I的结构简式是__________。
(3)写出G转化为H的化学方程式________________________。其反应类型为__________反应。
(4)化合物A—I中,易发生加成反应的物质是__________(填字母)。
2.(一)(1)科技日报
A.Al2H6中H为+1价,Al为-3价
B.Al2H6在空气中完全燃烧,产物为氧化铝和水
C.氢铝化合物Al2H6的晶体为分子晶体
D.氢铝化合物可能成为未来的储氢材料和火箭燃料
(二)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示。
化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
化学式 | A | A | B | D | A2E | DF |
回答下列问题:
(2)化合物丁的电子式为__________。F原子的最外层电子排布式为__________。
(3)化合物戊的沸点比甲__________(填“高”或“低”),写出甲与丁反应的化学方程式:____________________。
(4)
查看答案和解析>>
科目: 来源: 题型:
(一)制取氨气
(1)写出实验室制取氨气的化学方程式:________________。
(2)有一同学模仿排饱和食盐水收集氯气的方法用排饱和氯化铵溶液的方法收集氨气。但另一同学认为他不能达到目的,理由是_____________________________________________。
(二)该小组某同学设计如下图装置(夹持及尾气处理装置未画出),探究氨气的还原性:
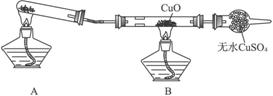
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是__________________。
(2)利用改进后的装置进行实验,CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。氨气与CuO反应的化学方程式为_________________。
(三)问题讨论
有同学认为NH3与CuO反应生成的红色物质中可能含有Cu2O,已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+![]() Cu+Cu2+)。请设计简单实验检验该红色物质中是否含有Cu2O:____________。
Cu+Cu2+)。请设计简单实验检验该红色物质中是否含有Cu2O:____________。
查看答案和解析>>
科目: 来源: 题型:
实验一:甲同学利用Al、Fe、Mg和2 mol·L-1的稀硫酸,设计实验方案研究影响反应速率的因素。
研究的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol·L-1硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
(1)该同学的实验目的是________________________;要得出正确的实验结论,还需控制的实验条件是________________________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置同温下进行定量实验。用大小形状相同的Fe分别和0.5 mol·L-1及2 mol·L-1的足量稀硫酸反应。通过______________可以说明浓度对化学反应速率的影响。

实验二:已知2KMnO4+5H![]() K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,可以在反应一开始时加入____________。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
查看答案和解析>>
科目: 来源: 题型:
①取
②取25.00 mL待测溶液转入锥形瓶中,并加入2—3滴0.2%的淀粉溶液;
③用标准碘溶液滴定待测溶液至终点,消耗20.00 mL 0.000 5 mol·L-1的标准碘溶液,发生反应:H3AsO3+I2+H2O![]() H3AsO4+2I-+2H+
H3AsO4+2I-+2H+
(1)简述如何对少量的中草药样品进行前期处理制得待测溶液?
(2)0.2%的淀粉溶液的作用是_____________________________________________________。
(3)所用标准碘溶液是由纯KIO3、过量的KI以及稀硫酸混合反应,并将其稀释而制得,该反应的离子方程式为______________________________________________________________。
(4)请计算该中草药样品中砷元素的含量为_________ mg/kg(保留至0.01,不写计算过程)。
查看答案和解析>>
科目: 来源: 题型:

(1)步骤②中,用硝酸而不用HI的原因是____________________________________。
(2)有人认为①中碘单质制出了氯单质,说明碘的氧化性强于氯气,你认为是否正确?为什么?
(3)实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有_______________。
(4)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为___________________________。
(5)参照下表碘酸钾的溶解度,步骤![]() 得到碘酸钾晶体,你建议的方法是___________。
得到碘酸钾晶体,你建议的方法是___________。
温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
KIO | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目: 来源: 题型:
(1)大气中氟氯烃的减少带来的积极效应是_________________________________________。
(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质。
①若用NOx表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:
![]()
②酸雨落至地面后pH在一定时间内变小然后稳定于某数值,原因是H2SO3受空气影响造成的,其化学方程式为_________________________________________。
(3)回收利用SO2既能减少大气污染,又能充分利用资源。已知:Fe2+、Fe3+作催化剂,标准状况下在转换器中SO2可被O2氧化成![]() ,实现SO2的回收利用。某同学设计测定转化器的脱硫效率方案如下:
,实现SO2的回收利用。某同学设计测定转化器的脱硫效率方案如下:

①在实验(Ⅰ)中,为了确定SO2的体积分数,可将模拟烟气缓慢通过已知体积和浓度的__________溶液,并用溶液的颜色刚好褪去时所消耗的模拟烟气的体积(标准状况下)来计算SO2的体积分数。
②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气体流速,还需测定的数据是__________和__________。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.
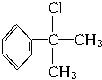
Ⅱ.苯的同系物与卤素单质混合,在光照条件下,只是侧链上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成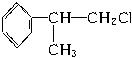
提示:CH3CH2X![]() CH3CH2OH
CH3CH2OH
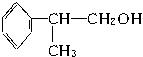
(1)A的结构简式可能为___________、___________。
(2)①③的反应类型分别为:①___________、③___________。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件)__________________。
(4)D的结构简式为________________。
(5)工业生产中中间产物A须经反应③④⑤得D,而不采取直接由A转化为D的原因为____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com