
科目: 来源: 题型:

(1)很多药物分子有手性碳而具有旋光性,A分子中有____________个手性碳原子。
(2)E的结构简式为____________。
(3)设计反应①的目的是________________________________________________。
(4)A与银氨溶液反应的化学方程式为(A以R—CHO表示)______________________。
(5)阅读以下信息,依据以上流程图和所给信息,以![]() 和
和![]() 为原料设计合成氨基酸
为原料设计合成氨基酸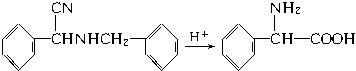 的路线。已知:
的路线。已知:

提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
A![]() B
B![]() C…→H
C…→H
查看答案和解析>>
科目: 来源: 题型:
(1)写出双硫腙和Fe3+络合的离子方程式:________________________。萃取过程中要控制适宜的酸度。如果溶液的pH过大,其后果是________________________。
下图是用双硫腙(H2Dz)—CCl4络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式被萃取分离的百分率。

某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)—CCl4络合萃取法处理废水。
请根据上图回答问题:
(2)欲完全将废水中的Hg2+分离出来,须控制溶液pH=____________。
(3)当调节pH=2时,铋(Bi)的存在形式有____________,其物质的量之比为__________。
(4)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)若①⑤⑥三种元素在周期表中相对位置如下图。①与⑤、①与⑥形成的液体化合物是常见的重要溶剂,则这三种元素最高价含氧酸酸性由强到弱的顺序是___________________。
![]()
(2)若下图中甲、乙、丙、丁、戊均为上述9种元素中的某些元素组成的单质或由其中两种元素组成的化合物。

①若甲是O2、乙是N2H4,置换反应是在强碱性溶液中进行的原电池反应,则负极发生的电极反应式为_______________。
②若戊为SO3,则乙可能是____________(填化学式)。
(3)若下图中A是常见的金属单质,B、C、D、E分别是上述9种元素中的某些元素组成的单质或其中两种元素组成的化合物。

①若该置换反应是在高温下进行的,在工业上有重要应用价值。物质C是一种两性化合物,则该反应的化学方程式为_____________________________________。
②若该置换反应是用A作阳极,在B的水溶液中进行电解反应。则反应a中阴极的电极反应式为______________________。
查看答案和解析>>
科目: 来源: 题型:

(1)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图)。其中a、c二步的化学方程式可表示为:___________________________、________________________。
(2)

(3)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如下图。

则:反应①②③④中属于氧化还原反应的是____________(填数字序号),反应①的离子方程式为____________________________________。该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵计量数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵计量数和温度:____________、____________。

查看答案和解析>>
科目: 来源: 题型:阅读理解
上述研究引起了甲、乙两位学生的极大兴趣,查阅文献后,得知钛铁矿还能被C还原:
2FeTiO3+C![]() 2Fe+2TiO2+CO2。
2Fe+2TiO2+CO2。
他们分别设计了两套实验装置模拟测定钛铁矿中可提取氧的质量分数的实验。
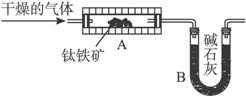
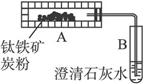
图1 图2
(1)学生甲设想用图1装置(A为电加热装置)从钛铁矿中提取氧,请写出最简便的实验步骤:____________(选填下列数字编号)。
①通入N2 ②停止通N2 ③通入H2 ④停止通H2 ⑤加热 ⑥停止加热 ⑦称取装置B的质量。
(2)学生乙设想用图2装置(A为电加热装置)从钛铁矿中提取氧,并且认为该方案的意义在于:反应产生的CO2可通过绿色植物的光合作用转化为营养物质,同时产生氧气(6O2+6H2O![]() C6H12O6+6O2)。实验过程中,称得反应前装置A中钛铁矿的质量为a g,炭粉的质量为b g,反应后装置B中产生CaCO3的质量为c g,则钛铁矿中可提取氧的质量分数的表达式为____________。
C6H12O6+6O2)。实验过程中,称得反应前装置A中钛铁矿的质量为a g,炭粉的质量为b g,反应后装置B中产生CaCO3的质量为c g,则钛铁矿中可提取氧的质量分数的表达式为____________。
(3)经专家评审后,认定两个方案都很有意义,但实验设计方面还存在不足之处,例如图2装置在加热时,还会产生CO,给实验带来误差。请提出对图2所示装置应采取的改进措施:__________。改进后,实验自始至终需持续向2装置A中通入N2的目的是_____________。
(4)科学家们选用H2而不用CO作还原剂的原因是:______________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(A)【物质结构与性质】
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

(1)T3+的核外电子排布式是____________。
(2)Q、R、M的第一电离能由大到小的顺序是___________________(用元素符号表示)。
(3)下列有关上述元素的说法中,正确的是______________________(填序号)。
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个π键
(4)加拿大天文台在太空发现了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线形分子,不存在配位键。写出其结构式:_________________。
(5)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是____________(填G或R的元素符号)。

(B)【实验化学】
某资料显示,能使双氧水分解的催化剂有很多种,生物催化剂(如猪肝)、离子型催化剂(如FeCl3)和固体催化剂(如MnO2)等都是较好的催化剂。某实验小组通过测定双氧水分解产生的O2的压强,探究分解过氧化氢的最佳催化剂以及探究最佳催化剂合适的催化条件。
(一)探究一:
实验步骤
(1)往锥形瓶中加入50 mL 1.5%的双氧水
(2)分别往锥形瓶中加
(3)采集和记录数据。
(4)整理数据得出下表
不同催化剂“压强对时间斜率”的比较
催化剂 | 猪肝 | 马铃薯 | 氯化铜 | 氯化铁 | 氧化铜 | 二氧化锰 |
压强对时间的斜率 | 0.191 87 | 0.002 42 | 0.007 93 | 0.030 5 | 0.015 47 | 1.833 6 |
①该“探究一”实验的名称是_____________________________________________________。
②该实验所得出的结论是_______________________________________________________。
(二)探究二:二氧化锰催化的最佳催化条件
该实验小组的同学在进行探究二的实验时,得到了一系列的图表和数据。参看下图和表格分别回答相关问题。

3%的双氧水与不同用量二氧化锰的压力—时间图
表:不同浓度的双氧水在不同用量的二氧化锰作用下收集相同状况下同体积O2所需时间
MnO2 时间 H2O2 | |||
1.5% | 223 s | 67 s | 56 s |
3.0% | 308 s | 109 s | 98 s |
4.5% | 395 s | 149 s | 116 s |
分析图、表中数据我们可以得出:
③同浓度的双氧水的分解速率随着二氧化锰用量的增加而_________________,因而反应时间_______________。
④如果从实验结果和节省药品的角度综合分析,你认为当我们选用3.0%的双氧水,加入___________ g的二氧化锰能使实验效果最佳。你判断的理由是______________________。
⑤该小组的某同学通过分析数据得出了当催化剂用量相同时双氧水的浓度越小反应速率越快的结论,你认为是否正确____________,你的理由是________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.恒温恒容时,当ClF转化40%时,容器内的压强为初始时的0.8倍
B.若c(F2)∶c(ClF)∶c(ClF3)=1∶1∶ 1,则反应一定达到平衡状态
C.达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移
D.平衡后再降低温度,保持恒容,达到新的平衡,则混合气体的平均摩尔质量增大
查看答案和解析>>
科目: 来源: 题型:
A.电池总反应为:Mg+H2O2![]() Mg(OH)2
Mg(OH)2
B.正极发生的电极反应为:H2O2+2H++2e-![]() 2H2O
2H2O
C.工作时,正极周围海水的pH增大
D.电池工作时,溶液中的H+向负极移动
查看答案和解析>>
科目: 来源: 题型:
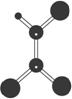
A.有机物化学式为C2HCl3 B.分子中所有原子在同一个平面内
C.该有机物难溶于水 D.可由乙炔和氯化氢加成得到
查看答案和解析>>
科目: 来源: 题型:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(![]() )+
)+![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com