
科目: 来源: 题型:
A.①②③④⑤ B.②③④①⑤ C.⑤④①②③ D.⑤④③②①
查看答案和解析>>
科目: 来源: 题型:
A.H、D、T互为同素异形体
B.氨气分子构型为正四面体形
C.NH4Cl的电子式为: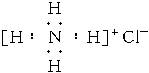
D.S2-的结构示意图为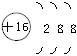
查看答案和解析>>
科目: 来源: 题型:
A.汽油中添加乙醇制备“乙醇汽油”,可有效减少有害气体的排放
B.养鸭厂添加苏丹红制“红心鸭蛋”,可使鸭蛋色泽鲜艳、美观
C.化妆品中添加含铬物质制美白润肤“SKⅢ”,可使女性青春永驻
D.汽水中添加林丹、 毒死蜱和七氯等杀虫剂制“××可乐”,以增强口感和余味
查看答案和解析>>
科目: 来源: 题型:阅读理解
A.《物质结构与性质》
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于__________晶体;基态Ni原子的电子排布式为__________。
(2)配合物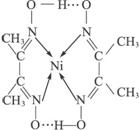 分子内的作用力有____________(填编号)。
分子内的作用力有____________(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中碳原子采取sp2杂化的分子有______________(填物质序号),预测HCHO分子的立体结构为___________形。
、④HCHO等,其中碳原子采取sp2杂化的分子有______________(填物质序号),预测HCHO分子的立体结构为___________形。
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如下图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为____________。

B.《实验化学》
乙醛与银氨溶液的反应常因条件控制不当,会出现黑色浊液、长时间没有银析出、析出的银镜不均匀或发暗等现象,影响了银镜反应的效果。
某研究小组为探究乙醛发生银镜反应的最佳实验条件,进行了有关实验,相关数据如下表:
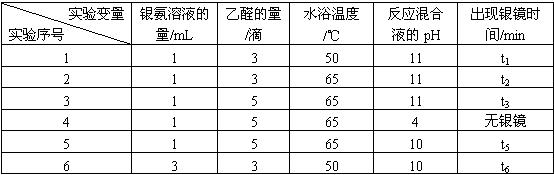 请回答下列问题:
请回答下列问题:
(1)写出乙醛与银氨溶液发生银镜反应的化学方程式:_______________________________。
(2)若只进行实验1和实验2,其探究的目的是_____________。
(3)实验__________(填序号)组合,可探究混合液pH对银镜反应的影响。
(4)实验4无银镜出现的原因是_____________________________________________。
(5)试管内壁的银镜用硝酸洗涤,可以回收硝酸银溶液。你认为选用____________(填“浓硝酸”或“稀硝酸”)较好,理由是___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)已知上述实验中发生的反应有:
KBrO3+5KBr+6HCl![]() 3Br2+3H2O+6KCl
3Br2+3H2O+6KCl
2Na2S2O3+I2![]() Na2S4O6+2NaI
Na2S4O6+2NaI
请写出实验中还涉及的另两个反应的化学方程式:_________________________________、________________________________________________。
(2)试计算此污水中苯酚的含量(以mg·L-1表示,苯酚的相对分子质量为94.00)。
查看答案和解析>>
科目: 来源: 题型:
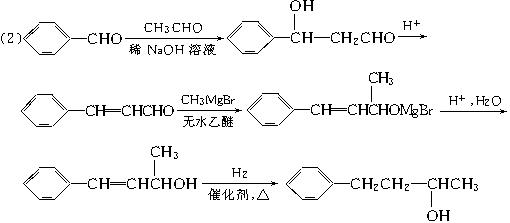
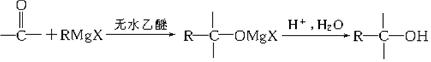
Ⅱ.格氏试剂(RMgX,X表示卤原子)与含羰基的化合物能发生如下反应:
(1)以柠檬醛为原料,按以下反应流程图合成维生素A:
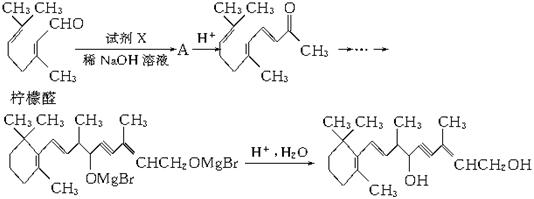
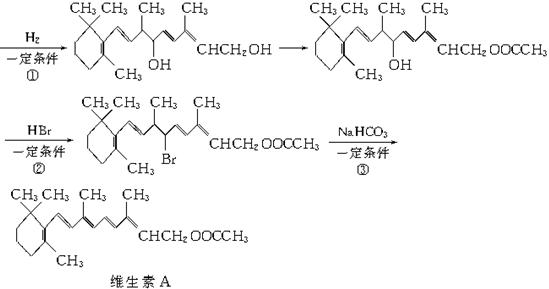
上述流程中,试剂X的结构简式为_____________,①②③的反应类型分别是_____________、_____________、_____________。
(2)利用题目所给信息和学过的反应原理,以![]() 、CH3CHO和CH3MgBr为有机原料(其他无机试剂任选),可以分5步合成
、CH3CHO和CH3MgBr为有机原料(其他无机试剂任选),可以分5步合成 ,用反应流程图表示。_______________________________________________________________。
,用反应流程图表示。_______________________________________________________________。
(3) 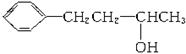 有多种同分异构体,其中属于酚类且苯环上只有两个对位基团的同分异构体共有______________种。
有多种同分异构体,其中属于酚类且苯环上只有两个对位基团的同分异构体共有______________种。
查看答案和解析>>
科目: 来源: 题型:
(1)工业上用NaCl还原NaClO3生产ClO2的工艺流程如下图所示:

①反应器中发生反应的化学方程式为:
2NaClO3+2NaCl+2H2SO4![]() 2ClO2↑+Cl2↑+2Na2SO4+2H2O
2ClO2↑+Cl2↑+2Na2SO4+2H2O
生产中将NaClO3和NaCl按物质的量之比1∶1.05的混合水溶液加入反应器,NaCl稍过量的目的是___________________________________________________________________。
②反应器中生成的ClO2和Cl2由通入空气驱出进入ClO2吸收塔,产生的混合液进入汽提塔,汽提塔排出的废液成分主要是______________(填化学式,下同)。
③以上生产流程中循环②循环利用的物质是______________。
④为提高ClO2的产量,可用亚氯酸钠(NaClO2)与反应器中的Cl2反应生成ClO2,该反应的化学方程式为________________________________________________。尾气中的Cl2可用SO2水溶液吸收,该反应的化学方程式为_____________________________________________。
(2)用阳离子交换膜分隔的电解池电解
A.电解时电子流向为:电源负极→导线→阴极,阳极→导线→电源正极
B.在电解过程中,Na+向阳极移动,![]() 向阴极移动
向阴极移动
C.在电解过程中阳极周围的pH基本不变
D.电解的离子方程式可表示为:2![]() +2H2O
+2H2O![]() 2ClO2↑+H2↑+2OH-
2ClO2↑+H2↑+2OH-
查看答案和解析>>
科目: 来源: 题型:
(2)在一定条件下进行如下反应:
aX(g)+bY(g)![]() cZ(g)
cZ(g)
下图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系示意图。

①写出该反应的化学平衡常数表达式:K=___________。随着温度的升高,K值___________ (填“增大”“减小”或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明__________(填序号)。
A.X的转化率越高 B.反应进行得越完全
C.达到平衡时X的浓度越大 D.化学反应速率越快
②如下图所示,相同温度下,在甲、乙两容器中各投入1 mol X、2 mol Y和适量催化剂,甲、乙两容器的初始体积均为
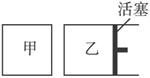
查看答案和解析>>
科目: 来源: 题型:

(1)若甲、乙均为非金属,丙为氧化物,则:
①乙为氧化产物时,乙可能是____________(填一种物质的化学式),按照元素周期表推测,此时反应物甲可能是_____________(填一种物质的化学式);
②乙为还原产物时,丁所属的物质类别是_____________。
(2)若该转化关系为我国古代湿法冶炼金属乙的原理,写出此反应的化学方程式:_________
________________________________________________________。若该转化关系为高温火法冶炼金属乙的原理,且同时生成的丁是一种有刺激性气味的气体,则丙可能为____________(填一种物质的化学式)。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.定性检验
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验②的目的是_______________________________________________________。
(2)由上述实验现象推断,黑色粉末X的成分是_________________________(填化学式)。
Ⅱ.定量测定

(1)操作Z是_____________。下列仪器中,在灼烧沉淀时必须用到的是_____________(填名称)。

(2)写出溶液Y中滴加H2O2溶液时发生反应的离子方程式:_________________________。
(3)通过以上数据,得出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com