
科目: 来源: 题型:
(1)向甲容器中通入3 mol N2和4 mol H2,反应达到平衡时,生成NH3 a mol。此时,NH3的物质的量分数是__________。若在达到平衡状态的甲容器中通入少量的N2,则达到新平衡时,体系中N2的体积分数将__________(选填“增大”“减小”或“不变”)。
(2)向乙中通入2 mol NH3,欲使反应达到平衡时,各物质的浓度与(1)中第一次平衡相同,则起始时还需通入__________mol N2和__________mol H2。
查看答案和解析>>
科目: 来源: 题型:

(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是___________________。
(2)若装置中缺B,其后果是_______________________。
(3)反应结束后,打开D中的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色,反应的化学方程式为________________________;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是____________________________________。(用方程式和必要的文字说明)
(4)C装置的作用是_______________________________________________________;
E中a仪器所起的作用是___________________________________________________。
(5)为测定该银圆中银的质量分数,还需进行的主要实验操作是:将A中溶液倒入烧杯中,然后加入过量的NaCl溶液,随后进行的操作为____________(用ABCD字母排序),最后测定溶液中Ag+的质量。
A.洗涤 B.过滤 C.称量 D.烘干
查看答案和解析>>
科目: 来源: 题型:
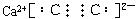
(1)写出B的电子式___________,D的结构简式___________。
(2)写出A与B反应的化学方程式____________________________________。
(3)将I气体通入溶有饱和C气体的NaCl溶液,是侯氏制碱法的一步关键反应,该反应的化学方程式为___________________________________。
(4)写出下列反应的离子方程式:
①在A溶液中加入M_________________________________。
②向A溶液中加入过量NaOH溶液,并加热________________________。
③已知Fe3O4能溶于M溶液并产生F气体,该离子方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
(1)B分子所含的官能团的名称是___________、___________。
(2)已知B是无支链的直链分子,下列关于B分子空间结构的说法正确的是__________。
①所有原子可能在同一平面 ②所有的碳原子在同一直线上
③所有碳原子在同一平面上 ④所有的原子在同一直线上
(3)A在酸性条件下水解的化学方程式:_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)高碘酸是____________(填写“强酸”或“弱酸”),原因是________________________。
(2)已知高碘酸和硫酸锰在溶液中反应生成高锰酸、碘酸及硫酸,此反应的氧化剂是____________,反应的离子方程式为______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.用98%的浓硫酸配制100 g 10%的稀硫酸溶液时,除使用量筒外还需用到容量瓶
B.用渗析法分离淀粉中混有的NaNO3杂质
C.无法用分液漏斗将乙二醇和水的混合液体分离
D.某无色溶液中加入盐酸产生无色无味气体,则溶液中一定含![]()
E.SO2、乙烯、乙炔通入溴水都能被氧化而使溴水褪色
F.用碱式滴定管量取20.00 mL 0.100 0 mol·L-1的KMnO4溶液
H.在中学“硫酸铜晶体里结晶水含量测定”的实验中,称量操作至少需要四次
查看答案和解析>>
科目: 来源: 题型:
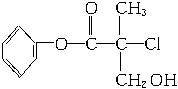
A.有机物A属于芳香烃
B.有机物A可以和Br2的CCl4溶液发生加成反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.1 mol A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH
查看答案和解析>>
科目: 来源: 题型:
A.肯定没有KNO3 B.肯定有KNO3,可能还有Na2CO3
C.肯定没有Ba(NO3)2,可能有KNO3 D.肯定没有Na2CO3和Ba(NO3)2
查看答案和解析>>
科目: 来源: 题型:

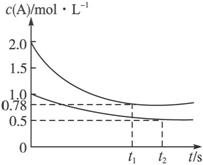
A.x可能等于3
B.向平衡后的乙容器中充入氦气可使A的转化率降低
C.将乙容器单独升温,c(A)可达到0.78 mol·L-1
D.若向甲容器中再充入2 mol A、4 mol B,平衡时甲容器中c(A)大于1.56 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
Fe2O3+3Na2O2![]() 2Na2FeO4+Na2O,下列说法正确的是
2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2既是氧化剂又是还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.3 mol Na2O2发生反应,有12 mol 电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com