
科目: 来源: 题型:
(1)a g铁分别与足量稀硫酸和高温水蒸气反应,产生气体的体积比为___________。
(2)现有某条件下(室温)m L CO、H2的混合气体,通过足量灼热的Fe3O4反应后,得到相同条件下(室温)的气体n L。原气体中H2的体积为___________ L。
(3)在800 mL 1 mol·L-1的稀硝酸中加入过量的铁粉,充分反应可产生标准状况下NO_________ L。反应后将溶液过滤(损失溶液忽略不计),向滤液中加入100 mL 1 mol·L-1稀硫酸又产生NO,再次产生标准状况下NO___________ L。
查看答案和解析>>
科目: 来源: 题型:阅读理解

(1)先关闭活塞a,将6.4 g铜片和12 mL18 mol·L-1的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式:
打开活塞a之前_________________________________________________________,
打开活塞a之后_________________________________________________________,
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在答题卷的图上把导管补充完整。
(2)实际上,在打开活塞a之前硫酸仍有剩余。为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量。他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况)。你认为甲学生设计的实验方案中D装置中的试剂为___________(填化学式)。
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100 mL溶液,再取20 mL于锥形瓶中,用_______________________作指示剂,用标准氢氧化钠溶液进行滴定〔已知:Cu(OH)2开始沉淀的pH约为5〕,选择该指示剂的理由为____________________________________;再求出余酸的物质的量,若耗去a mol·L-1氢氧化钠溶液b mL,则原余酸的物质的量为_________ mol。(用含a、b的表达式来表示)
查看答案和解析>>
科目: 来源: 题型:
A.用渗析法分离淀粉中混有的NaCl杂质
B.用浓氨水洗涤做过银镜反应的试管
C.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分
D.用酸式滴定管量取20.00 mL高锰酸钾溶液
查看答案和解析>>
科目: 来源: 题型:
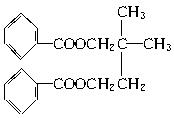
已知:①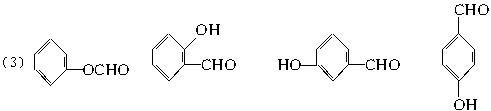
②![]()
又知G的分子式为C5H12O2,试回答:
(1)反应①—⑤中属于取代反应的有____________(填写编号)。写出E中所含官能团的名称:________________________。
(2)写出B、H的结构简式:B____________,H____________。
(3)写出与I互为同分异构体,既含有苯环又能发生银镜反应的所有物质的结构简式:____________、____________、____________、____________。
(4)写出D→F的化学方程式:____________。
(5)反应②的化学方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
(1)该氮氢化合物的分子式为____________。
(2)32.0 g该液态氮氢化合物在氧气中完全燃烧生成氮气,放出热量为624 kJ(在101 kPa ,25 ℃),则该氮氢化合物完全燃烧的热化学方程式为________________________________。
(3)该液态氮氢化合物与空气的燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液,则写出此时电池的反应式:
正极的电极反应_________________________________________________________,
负极的电极反应_________________________________________________________。
(4)传统的制备该液态氮氢化合物的方法是以NaClO氧化NH3制得的,请写出该反应的离子方程式__________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:

(1)写出下列物质的化学式:B____________,E____________,F的结构式____________。
(2)反应①的离子方程式为_______________________________。
(3)足量铁与G的热的浓溶液反应所得气体是______________;铁与B反应的化学方程式为_______________________________________。
(4)C是一种重要的化工产品,为易挥发的樱桃红色液体。若反应②中生成的G、A和I的物质的量之比为1∶2∶6,则C的电子式为_______________,反应②的化学方程式为_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
①滴加适量的Na3BiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体。请回答下列问题:
(1)Bi元素在周期表中的位置_______________________________________________;
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为_______________________________;
(3)实验④中的现象为______________________________________________________;
(4)实验②反应的离子方程式是______________________________________________;
(5)实验③反应的离子方程式是_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.Na2CO3、Na2O2和O2 B.Na2CO3、O2和H2O(g)
C.Na2CO3、CO2、O2和H2O(g) D.NaHCO3、Na2CO3和O2
查看答案和解析>>
科目: 来源: 题型:
| 50 mL盐酸 | 50 mL盐酸 | 50 mL盐酸 |
m(混合物) | 9.2 g | 15.7 g | 27.6 g |
V(CO2)(标准状况) | 2.24 L | 3.36 L | 3.36 L |
A.盐酸的物质的量浓度为3.0 mol·L-1
B.根据表中数据能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2 g时盐酸过量
D.15.7 g混合物恰好与盐酸完全反应
查看答案和解析>>
科目: 来源: 题型:
A.物质A的转化率降低了 B.正反应速率增大,逆反应速率减小
C.物质C的质量分数增加了 D.a+b>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com