
科目: 来源: 题型:

Ⅰ
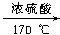
Ⅱ
(1)装置A中发生反应的化学方程式为__________________________________________。
(2)分液漏斗中盛有液体,但打开分液漏斗的活塞时液体不能顺利流下,可能的原因是___
____________________________________________________________________。
(3)装置X的作用是贮存气体,X中广口瓶内应盛放的液体最好是__________。
①Na2CO3溶液 ②酸性高锰酸钾溶液 ③Na2SO4溶液 ④饱和NaHSO3溶液
(4)装置Y、Z中产生的现象相同,但原因不同,Y中是由于(写离子方程式)____________
__________________________________,而Z中则是由于SO2具有_______________。
(5)实验需要收集多瓶二氧化硫气体,在更换集气瓶时,为了减少二氧化硫逸散到空气中,将图Ⅰ中的B部分更换为图Ⅱ所示装置,可以用a、b集气瓶交替收集二氧化硫气体,请回答:
①检查集气瓶b是否漏气的方法是__________________________________________。
②若只用集气瓶a收集气体,在装置气密性良好,并加入药品后,准备制取并收集二氧化硫气体,下一步的操作是________________________________________________。
(6)①若用A装置作为实验室制取乙烯的发生装置,应对A装置作何改进?
____________________________________________________________________
____________________________________________________________________。
②烧瓶中应加入碎瓷片,目的是__________________________________________________。
③写出实验室制取乙烯的化学方程式:____________________________________________。
查看答案和解析>>
科目: 来源: 题型:

回答下列问题:
(1)化合物E、M的沸点____________高(填化学式),原因是_______________________。
(2)甲、乙两种元素还可以形成一种含有4个原子核和18个电子的化合物,该化合物的结构式为_________________________________。
(3)E与D高温反应的化学方程式为________________________,K与M在水溶液中反应的离子方程式为____________________________________________。
(4)实验室在保存L溶液时,需加入少量D,理由是________________________,实验室检验L的水溶液中的阳离子的方法是________________________________________。
(5)已知一定条件下每1 mol F与单质B完全反应生成I放热98.0 kJ,若2 mol F与1 mol B在此条件下发生反应,达平衡时,放出热量为176.4 kJ,则F的转化率为____________,平衡时F的物质的量为____________,若保持温度和压强不变(反应混合物都为气体)按下列四种配比作为起始物质充入,达到平衡时各物质的物质的量与上述平衡状态相同的是_______________。
A.4 mol F 2 mol B
B.2 mol F 1 mol B 2 mol I
C.1 mol F 0.5 mol B 1 mol I
D.3 mol I 1 mol Ne
查看答案和解析>>
科目: 来源: 题型:
(1)甲的电子式为____________,其分子为____________分子(填“极性”或“非极性”)。
(2)工业生产E元素的单质的化学方程式为______________________________________。
(3)A单质与C单质在一定条件下可化合为乙,工业生产乙的条件为________________,室温下,向pH=a的乙的水溶液中加入等体积pH=b的甲的水溶液,且a+b=14,充分作用后,溶液Ph______________7 (填“>”“<”或“=”),该溶液中各种离子浓度由大到小的顺序为______________________________________。
(4)C、D两元素可形成多种化合物,其中某一化合物含C元素质量分数为46.67%,写出该化合物的化学式__________________________,将它转化为C的最高价含氧酸的化学方程式为____________________________________________________________________。
(5)A、B两元素也可形成多种化合物,其中相对分子质量最小的分子为丙,则丙的空间构型为____________。用D的单质和丙可以制成原电池,电池中装有浓KOH溶液,用多孔的惰性电极浸入浓KOH溶液中,在X极通入化合物丙,Y极通入D的单质,则X极是该电池的___________极,X极的电极反应式为_________________________。
查看答案和解析>>
科目: 来源: 题型:

图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同。已知:
①甲、乙是同一类晶体中的各自结构单元,单质甲能与乙发生置换反应
②丙、丁、戊三种粒子含有等量的电子数,其中丙、丁是同一类晶体中的分子或分子集团
③常温下丁呈液态,能产生两种等电子数的粒子
④戊是阳离子
(1)甲与乙发生置换反应的化学方程式是________________________________________。
(2)写出液态丁产生两种等电子粒子的电离方程式:______________________________。
(3)丙是目前重要的能源,丙和丁在催化、加热条件下得到两种可燃性的气体,其反应的化学方程式是___________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
Al+NaNO3+H2O![]() Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2
(1)该反应的氧化剂是____________。
(2)该反应的氧化产物是____________。
(3)反应过程中转移 5 mol e-,生成标准状况下N2的体积是____________ L。
(4)配平该反应的化学方程式:
______Al+_______NaNO3+________H2O![]() _______Al (OH)3+_______N2+ _________NaAlO2。
_______Al (OH)3+_______N2+ _________NaAlO2。
查看答案和解析>>
科目: 来源: 题型:
A.用干燥、洁净的玻璃棒蘸取待测液滴在pH试纸(置于表面皿内)上测溶液的pH
B.烧瓶、锥形瓶、蒸发皿加热时都要垫石棉网
C.制备Fe(OH)3胶体时,应往沸水中加饱和FeCl3溶液,并继续加热至溶液呈红褐色为止
D.在中学“硫酸铜晶体里结晶水含量的测定”的实验中,至少需要进行四次称量操作
查看答案和解析>>
科目: 来源: 题型:
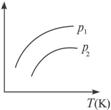
①一定条件下L的转化率 ②混合气体中M的百分含量 ③混合气体中L的百分含量 ④混合气体中的平均相对分子质量
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目: 来源: 题型:
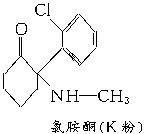
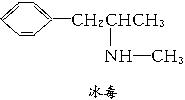
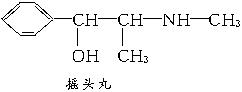
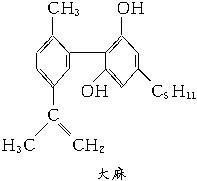
A.这四种毒品都属于芳香族化合物
B.K粉的分子式为C13H12ClNO
C.1 mol大麻最多可与含3 mol Br2的溴水发生反应
D.摇头丸在一定条件下可发生加成反应
查看答案和解析>>
科目: 来源: 题型:
A.室温下0.1 mol·L-1的NaHCO3溶液中,若pH>7,则c(![]() )>c(H2CO3)
)>c(H2CO3)
B.相同条件下,等物质的量浓度的NH4Cl和NH4HSO4溶液,前者溶液中![]() 浓度较小
浓度较小
C.在室温下,某溶液中由水电离出的c(H+)=10-3 mol·L-1,则此溶液可能是盐酸
D.加水稀释稀醋酸溶液,溶液中所有离子浓度都会减小
查看答案和解析>>
科目: 来源: 题型:
A.反应物总能量低于生成物总能量时,该反应不能发生
B.稀的强酸与稀的强碱反应放出的热量就是中和热
C.由C(石墨,s)![]() C(金刚石,s);ΔH>0可知石墨比金刚石稳定
C(金刚石,s);ΔH>0可知石墨比金刚石稳定
D.在101 kPa,25 ℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ的热量;氢气燃烧的热化学方程式表示为2H2(g)+O2(g) ![]() 2H2O(l);ΔH=-285.8 kJ·mol-1
2H2O(l);ΔH=-285.8 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com