
科目: 来源: 题型:
(Ⅰ)草酸晶体(H
(Ⅱ)无水草酸大约在
HOOC—COOH![]() CO2↑+CO↑+H2O↑
CO2↑+CO↑+H2O↑
(Ⅲ)H![]() BaC2O4↓+2H2O
BaC2O4↓+2H2O
该小组采用下图所示的实验装置,通过实验验证无水草酸受热分解的产物,并利用反应产生的纯净CO气体来还原铁的某种氧化物(FezOy),以确定FexOy的组成。

请回答下列问题:
(1)实验所需的仪器如上图所示,各仪器的连接顺序为:e接________、_________接_________、_________接______。
(2)该组同学进行了下列实验操作,其操作先后顺序为________________。
①点燃B处左侧的酒精灯;
②检验实验装置的气密性;
③反应结束后,熄灭酒精灯;
④点燃C处的酒精灯,开始反应,并对装置B的d口处气体进行验纯,点燃尖嘴d处的酒精灯;
⑤向实验装置中装入药品
(3)D装置中澄清石灰水的作用________________________________,
B装置中澄清石灰水的作用________________________________________________。
(4)B装置中d处酒精灯的作用是________________________________。
(5)已知硬质玻璃管的质量为
(6)该小组设计的实验________________(填“有”或“无”)不妥之处。如有不妥,请说出不妥的原因________________。
查看答案和解析>>
科目: 来源: 题型:

已知:
| 氢氧化物开始沉淀时的pH | 氯氧化物沉淀完全时的pH |
Fe3+ | 1.9 | 3.2 |
Cu2+ | 4.7 | 6.7 |
(1)下列物质中,最适合作为氧化剂X的是_____________________(填序号)
A.H2O2 B.KMnO
写出加入X后发生反应离子的方程式_____________________。
(2)加入的物质Y可以是,目的是________________________________________。
(3)某同学利用反应Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
设计实验来制取氯化铜溶液。该同学设计的装置应该为________________。(填“原电池”或“电解池”)。请在下侧方框中画出该同学设计的装置图,并指明电极材料和电解质溶液。
|
(4)从CuCl2稀溶液中得到CuCl2·2H2O晶体,在蒸发结晶的过程中,为了防止Cu2+的水解,应采取的措施是________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中________________能导致酸雨的形成;目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。
如:CO(g)+NO2(g)![]() NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
据此回答:若用标准状况下
(2)在火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏(CaSO4·2H2O)。写出有关的化学反应方程式______________。
(3)硫酸工业生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ·mol-1
2SO3(g) ΔH=-196 kJ·mol-1

某温度下达到平衡时,SO2的体积百分含量与体系的总压强的关系如上图所示:
据此图回答下列问题:
①平衡状态由A变到B时,反应体系____________(填“吸收”或“释放”)能量。
②将5 mol SO2和7 mol O2通入
查看答案和解析>>
科目: 来源: 题型:
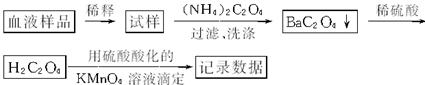
有关反应的化学方程式为:
2KMnO4+5H![]() K2SO4+2MnSO4+10CO2↑+8H2O,若血液样品为15 mL,滴定生成的草酸消耗0.001 mol·L-1的KMnO4溶液15.0 mL,则这种血液样品中的含钙量为
K2SO4+2MnSO4+10CO2↑+8H2O,若血液样品为15 mL,滴定生成的草酸消耗0.001 mol·L-1的KMnO4溶液15.0 mL,则这种血液样品中的含钙量为
C.0.000 3 mol·L-1 D.0.003 5 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
A.所有主族元素正化合价数等于它的族序数
B.Ⅶ A族元素的原子随核电荷数的增加,得电子能力逐渐减弱
C.ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
D.前三周期元素中共有非金属元素12种
查看答案和解析>>
科目: 来源: 题型:
①H2B![]() H++HB-,②HB-
H++HB-,②HB-![]() H++B2-。关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是
H++B2-。关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.c(Na+)=c(HB-)+c(B2-)+c(H2B)
D.NaHB和NaOH溶液反应的离子方程式为H++OH-![]() H2O
H2O
查看答案和解析>>
科目: 来源: 题型:
A.金刚石是碳的一种同位素
B.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
C.离子化合物均属于强电解质,都易溶于水
D.离子键、共价键都属于静电作用
查看答案和解析>>
科目: 来源: 题型:
A.形成化学键吸收能量,破坏化学键释放能量
B
C.向豆浆中加入硫酸钙溶液会产生聚沉现象
D.H+、![]() 、Fe2+、Na+在溶液中不能大量共存
、Fe2+、Na+在溶液中不能大量共存
查看答案和解析>>
科目: 来源: 题型:
A.丙烷既能发生取代反应,又能发生加成反应
B.丙烷完全燃烧,其产物对空气没有污染
C.丙烷燃料电池中,丙烷在正极发生反应
D.丙烷的一氯取代物有三种同分异构体
查看答案和解析>>
科目: 来源: 题型:
A.推广使用“乙醇汽油”,有利于节能减排
B.使用“无磷洗涤剂”,能有效减少水体富营养化的发生
C.“无氟冰箱”的使用,有利于臭氧层的保护
D.向海水中加入净水剂明矾可以使海水淡化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com