
科目: 来源: 题型:
A.原子是化学变化中的最小微粒,所以化学反应中不可能产生新的元素
B.1H2、2H2、3H2都是氢元素的核素
C.某阴离子的结构示意图为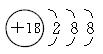
D.非金属元素原子间只能形成共价键,金属元素原子与非金属元素原子间只能形成离子键
查看答案和解析>>
科目: 来源: 题型:
A![]()
B
C.Na2O2与水反应生成1 mol O2转移NA个电子
D
查看答案和解析>>
科目: 来源: 题型:
A.在有机物中碳原子与其他原子最多形成4个共价键
B.用溴水既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯
C.煤中含有大量的苯、甲苯、二甲苯等有机物,因此可以通过干馏的方法将其提纯出来
D.油脂、淀粉、蛋白质都是人体必需的营养物质,它们都可以在一定条件下发生水解
查看答案和解析>>
科目: 来源: 题型:
下列框图中A、F、G、H都是芳香族化合物。A的相对分子质量不超过200,完全燃烧只生成CO2和H2O;A中氧元素的质量分数为![]() 。
。
又已知:①G、E均能发生银镜反应;②F与NaHCO3溶液反应能生成气体;③C的水溶液被称为福尔马林。
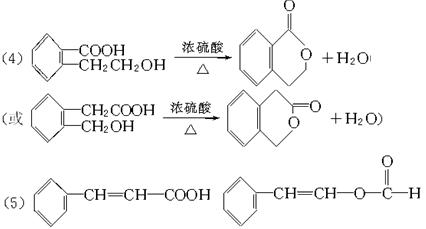
回答下列问题:
(1)E产生的核磁共振氢谱图上有____________________种峰。
(2)C和苯酚反应生成酚醛树脂的反应类型为____________________(选填序号)。
①消去反应 ②取代反应 ③加成反应 ④缩聚反应
(3)一个A的分子中应有____________________个(选填2、3、4…等)氧原子。
(4)由F生成H的化学方程式为____________________。
(5)H的同分异构体甚多。请写出符合下列条件的同分异构体的结构简式(任写两种):
①苯环上只有一个取代基;②能够与NaOH溶液反应。____________________。
查看答案和解析>>
科目: 来源: 题型:
下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
(1)请写出下图中d单质对应元素原子的电子排布式__________________。
(2)单质a、f对应的元素以原子个数比1∶1形成的分子(相同条件下对H2的相对密度为13)中含________个σ键和_________个π键。
(3)a与b的元素形成的10电子中性分子X的空间构型为;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到配合物的化学式为__________________,其中X与Ag+之间以__________________键结合。
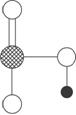
(4)下图是上述六种元素中的一种元素形成的含氧酸的结构;请简要说明该物质易溶于水的原因___________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(1)甲小组进行中和滴定实验,实验室里提供了下面几种仪器:酸式滴定管、碱式滴定管、量筒、托盘天平、普通漏斗、玻璃棒、烧杯,你认为还缺少的玻璃仪器是__________。
(2)乙小组设计了如下图所示的一套实验装置,以探究该装置的多功能性。

①李明同学认为该装置可以用来制取、收集SO2气体,其中Ⅲ中盛有NaOH溶液。乙小组同学经过讨论后认为该装置存在安全隐患,需要将Ⅲ进行改装,请将改装后的装置图画在方框内。
②王强同学认为可利用该装置快速制取、净化、收集氨气。其中Ⅱ中盛有浓硫酸。你认为是否正确,若正确则不需作答;若不正确,提出改进意见___________________。
(3)丙小组进入了一家回收含铜电缆废料的工厂做社会调查,技术员向同学们展示了两个处理方案,并向同学们提出下列问题:
方案1:

方案2:

①你认为方案___________________更符合当前绿色生产的理念。
②写出方案1中步骤Ⅱ反应的离子方程式__________________。
③技术员指出,无论是方案1还是方案2,都应加入稍过量的铁屑并最终除去,请你设计出去铁屑的操作方法______________________________________________________。
④为了增加经济效益,该工厂把最后一步所得浅绿色溶液,通过__________________、冷却结晶、过滤、洗涤、自然干燥得到一种俗称“绿矾”的工业产品。
⑤丙组同学经查询资料、研究、讨论,又设计了方案3,即把方案2中“加入足量稀硫酸、通入空气并加热”改为“加入足量稀硫酸和H2O
查看答案和解析>>
科目: 来源: 题型:

(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数是最内层电子数的![]() ,N元素最高价与它的负价代数和为6。
,N元素最高价与它的负价代数和为6。
①写出反应Ⅱ的离子方程式______________________________。
②下图为反应Ⅳ达平衡后改变反应条件,反应速率随时间变化的情况,已知t2—t3阶段为使用催化剂;t3—t4阶段为减小体系的压强,写出符合上述条件的化学方程式___________________(写一个即可,用具体物质表示);若t4—t5阶段为升高体系的温度,则该反应为___________________(填“放热”或“吸热”)。

③某温度下,四个容器中均进行着上述反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
容器编号 | c(C)/mol·L-1 | c(D)/mol·L-1 | c(G)/mol·L-1 | v正、v逆比较 |
甲 | 0.06 | 0.60 | 0.60 | v正=v逆 |
乙 | 0.06 | 0.50 | 0.40 |
|
丙 | 0.12 | 0.40 | 0.80 | v正<v逆 |
丁 | 0.12 | 0.30 |
| v正=v逆 |
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应Ⅱ需要B与A的浓溶液共热才能进行,且生成的E与G是同一种物质。写出反应Ⅰ的化学方程式___________________;
查看答案和解析>>
科目: 来源: 题型:
(1)经测定,A2D2的水溶液呈弱酸性。请写出第一步的电离方程式。
(2)用甲和单质D2可设计呈燃料电池,若电解质溶液为浓KOH溶液,则正极的电极反应式为______________________________。
(3)
(4)单质F与E的最高价氧化物的水化物的溶液反应的离子方程式是_______________。
(5)常温下向25 mL 0.1 mol·L-1丙溶液中逐滴滴加0.1 mol·L-1丁溶液,滴加过程中混合溶液pH的变化曲线如下图所示:

①图中m点由水电离出的OH-的物质的量浓度为___________________;
②p点时,丙溶液和丁溶液恰好完全反应,则p点溶液中各种离子浓度由大到小的顺序为_____________________。
查看答案和解析>>
科目: 来源: 题型:
A.反应中转移电子2 mol
B.该反应中的氧化剂为CuI
C.该反应被氧化元素是汞元素
D.Cu2HgI4即是氧化产物又是还原产物
查看答案和解析>>
科目: 来源: 题型:
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中,Cl-的物质的量为0.02 mol
D.在最终得到的溶液中,Cu2+的物质的量浓度为0.01 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com