
科目: 来源: 题型:
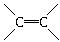
A.靛蓝由碳、氢、氧、氮四种元素组成
B.它的分子式是C16H10N2O2
C.它可以在一定条件下与氢气发生加成反应
D.该物质是高分子化合物
查看答案和解析>>
科目: 来源: 题型:
下图是某药物中间体的结构示意图:
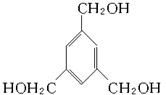
试回答下列问题:
(1)观察上面的结构式与立体模型,通过对比指出结构式中的“Et”表示______________;该药物中间体的分子式为____________________________。
(2)请你根据结构示意图,推测该化合物所能发生的反应及所需反应条件______________。
(3)解决有机分子结构问题的最强有力手段是核磁共振氢谱(PMR)。有机化合物分子中有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰。
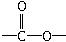
现有一种芳香族化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如上图所示,试写出该化合物的结构简式:____________________________
查看答案和解析>>
科目: 来源: 题型:
下表是元素周期的一部分,其中所列字母分别代表某一元素。
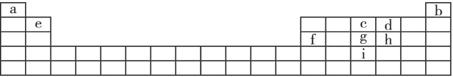
请根据表中所列a—i九种元素,回答下列问题:
(1)基态原子的价电子层中,未成对电子数最多并且原子半径最小的元素的价电子层的电子排布式________________;当此元素的原子与a元素的原子形成简单的分子时,该元素的原子杂化方式______________,所形成简单分子的立体构型为______________,该分子为______________分子(填“极性”或“非极性”)。
(2)d、g、i分别与a形成化合物,推断所形成的化合物沸点由高到低的排列顺序为______________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
某省2007年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9 %,阳离子以铵根离子为主,约占阳离子总量的84.1 %。阴离子中![]() 和
和![]() 的质量比为4.13∶1,
的质量比为4.13∶1,![]() 的比例呈明显上升的趋势。
的比例呈明显上升的趋势。
回答下列问题:
(1)该省大气污染特征是_________
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
(2)请你提出该省防治酸雨的两条主要措施_________________________;
(3)某校研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究。
①参加该课题的探究,在小组讨论测定地点时,选择的测定地点分别是工厂、学校、村庄(或居民住宅区)、公园(或农田)等。
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262—94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是_______________________。③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:

该反应类型属于______________________________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(2)验证和探究:①![]() 的验证:取少量固体药品于试管中,然后加水溶解,再滴加______________浓溶液,将______________置于试管口部,加热试管,若______________,则证明含
的验证:取少量固体药品于试管中,然后加水溶解,再滴加______________浓溶液,将______________置于试管口部,加热试管,若______________,则证明含![]() 。
。
②阴离子的探究:
a.取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入下列装置。观察到的现象是:溴水无明显变化,澄清石灰水变浑浊。再向滴加稀盐酸反应后的试管中,加Ba(OH)2溶液,无明显现象。
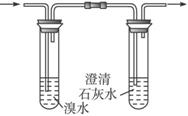
初步结论:“氢铵”是______________的铵盐。
b.要进一步确定“氢铵”的成分还需要补做如下实验:取适量“氢铵”配制成溶液,取试液于一支洁净的试管中,加足量BaCl2溶液振荡充分反应,若不产生白色沉淀,说明该化肥主要成分为_____________。若产生白色沉淀,过滤,取滤液加适量的Ba(OH)2溶液,也产生白色沉淀,说明该化肥主要成分为______________;若不产生白色沉淀,说明该化肥主要成分为______________。
(3)该实验小组设计了以下两个实验方案测定该化肥的含氮量,请你阅读后解释方案中提出的问题并进行评价:
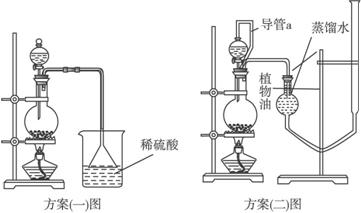
方案(一):准确称取一定质量的样品,放入上图方案(一)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置,通过实验测定烧杯增加的质量(忽略漏斗中附着溶液的质量)。然后进行计算,可得化肥的含氮量。
方案(二):准确称取一定质量的样品,放入上图方案(二)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置(A管可以上下移动),测量生成的氨气体积(设所测体积为标准状况下的体积)。然后进行计算,可得化肥的含氮量。
方案(二)图中导管a的作用是__________________________________________。
请你评价上述两套方案是否合理。若合理只需要说明结论;若不合理,请简要说明原因:
方案(一):____________________________________________________________。
方案(二):_____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:

(1)若A、D、F都是非金属单质,常温下,A、D为固体,D单质可作为半导体材料,F为气体,且A、D所含元素为同主族短周期元素,A、F所含元素同周期,则反应①的化学方程式是______________________________。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,C的溶液为浅绿色,则反应②(在水溶液中进行)的离子方程式是:______________________
(3)若B、C、F都是气态单质,B有毒且呈黄绿色,反应③中有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则反应③的化学方程式是______________
(4)若A、B、D为有机物,B的相对分子质量比A大14,E、F为无机物单质,F是短周期中原子半径最大的元素。C为最常见的氧化物,通常状况下为液态,C能与乙烯在一定条件下发生加成反应生成A。则E的化学式为______________,D的结构简式为______________,反应①属于______________反应,反应③的化学方程式为______________
查看答案和解析>>
科目: 来源: 题型:
(1)氢气燃烧热值高。实验测得,在常温常压下,
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,正极的电极反应式为__________________________________________

②上图装置中,某一铜电极的质量减轻
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-92.4 kJ/mol
2NH3(g)ΔH=-92.4 kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。

图中t1时引起平衡移动的条件可能是___________________其中表示平衡混合物中NH3的含量最高的一段时间是_________________。②温度为T℃时,将
查看答案和解析>>
科目: 来源: 题型:
A.欲配制质量分数为10%的ZnSO4溶液,将
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AlCl3和MgCl2溶液,取三种溶液分别滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
查看答案和解析>>
科目: 来源: 题型:

A
B
C
D
查看答案和解析>>
科目: 来源: 题型:
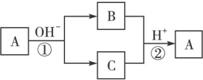
A.X元素可能为Al B.X元素一定为非金属元素
C.反应①和②互为可逆反应 D.反应①和②不一定为氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com