
科目: 来源: 题型:
A.铁片放入稀盐酸中:2Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
B.大理石放入稀硝酸中:![]() +2H+
+2H+![]() CO2↑+H2O
CO2↑+H2O
C.铁片插入硫酸铜溶液中:2Fe+Cu2+![]() Cu+2Fe2+
Cu+2Fe2+
D.硫酸铜与氢氧化钡溶液反应:Cu2++![]() +Ba2++2OH-
+Ba2++2OH-![]() Cu(OH)2↓+BaSO4↓
Cu(OH)2↓+BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
A.在标准状况下,
B.常温常压下,1 mol氩气所含的原子个数为2NA
C.
D.某氧化剂与浓盐酸反应,产生1 mol氯气,所转移的电子数目一定为2NA
查看答案和解析>>
科目: 来源: 题型:
A.2 mo1·L-1 B.1 mo1·L-1
C.0.5 mo1·L-1 D.0.05 mo1·L-1
查看答案和解析>>
科目: 来源: 题型:
A.发展循环经济,构建资源节约型社会及清洁生产技术
B.采用绿色化学生产工艺,建立环境友好型化工体系
C.大力开发可再生资源,推广用乙醇汽油代替传统的燃油
D.设计化学实验方案时,提倡用尽可能多的样品和试剂以提高实验效果
查看答案和解析>>
科目: 来源: 题型:
我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。PETG的结构简式如下:

这种材料可采用如下图所示的合成路线

![]()
(2)RCOOR1+R2OH![]() RCOOR2+R1OH(R、R1、R2表示烃基)
RCOOR2+R1OH(R、R1、R2表示烃基)
试回答下列问题:
(1)⑦的反应类型是__________________________________________。
(2)写出I的结构简式:_____________________________________________。
(3)合成时应控制的单体的物质的量:n(H)∶n(E)∶n(D)=____________(用m、n表示)。
(4)写出反应②的化学方程式:____________________________________。
(5)写出同时符合下列两项要求的E的所有同分异构体的结构简式。
①该同分异构体的苯环上相邻的三个碳原子上都连有取代基。
②该同分异构体在一定条件下能发生银镜反应和水解反应,遇到FeCl3溶液显紫色。
__________________、_____________、_____________。
查看答案和解析>>
科目: 来源: 题型:
现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图______________________________。
写出元素Z的电子排布式_____________________________________________。
(2)写出Y元素最高价氧化物对应的水化物的电离方程式_______________。
(3)元素T与氯元素相比,非金属性较强的是_______________(用元素符号表示),下列表述中能证明这一事实的是_______________。
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是_______________(用元素符号表示),理由是__________。
查看答案和解析>>
科目: 来源: 题型:
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:


氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7 g NH4Cl,理论上需NaCl_______________g。
(2)实验室进行蒸发浓缩用到的主要仪器有_______________、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为_______________。
(4)不用其他试剂,检查NH4Cl产品是否纯净的方法及操作是_______________。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是_______________。
查看答案和解析>>
科目: 来源: 题型:
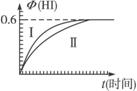
(1)达平衡时,I2(g)的物质的量浓度为______________mol·L-1。
(2)若改变反应条件,在某条件下Φ(HI)的变化如曲线(Ⅰ)所示,则该条件可能是_________________(填入下列条件的序号)。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(g)(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的关系为______________(用一个含a、b、c的代数式表示)。
(4)室温时将0.01 mol HI气体溶于水配成100 ml 溶液,则该溶液中由水电离产生的氢离子的物质的量浓度为____________mol·L-1;若降低温度该溶液的pH将____________(填增大、减小或不变)。
查看答案和解析>>
科目: 来源: 题型:

请回答下列问题:
(1)若甲在转化中为还原剂,是常见金属,乙是常见非金属单质,丙可以使带火星的木条复燃,且甲、乙、丙由短周期元素组成。则A的结构式是__________________。
A与甲反应的化学方程式是____________________________________。
(2)若甲在转化中为氧化剂,是常见非金属气态单质,丙是常见金属,甲、乙、丙中只有甲由短周期元素组成,且乙与甲同主族,与丙同周期,乙是常温下唯一的液体非金属单质,也有强氧化性。通常条件下反应都在溶液中进行。则:
①单质丙是(写元素符号)____________________________________。
②A与乙反应的离子方程式为____________________________________。
③当A与甲的物质的量之比为2∶3时,A与甲恰好完全反应,并符合上图所示,则A的溶液跟甲反应的化学方程式为 ____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com