
科目: 来源: 题型:
①a=1,b=1 ②a=2,b=1 ③a=2,b=2 ④a=3,b=2
A.①④ B.②④ C.①③ D.②③
查看答案和解析>>
科目: 来源: 题型:
A.室温下,
B.在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2NA
C.铁、铜和稀硫酸构成原电池,当转移了NA个电子时,产生的气体体积一定为
D.关于反应C2H2(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+H2O(l);ΔH=-1 300 kJ·mol-1,在CO2中若有4NA对共用电子对形成时,放出1 300 kJ的能量
2CO2(g)+H2O(l);ΔH=-1 300 kJ·mol-1,在CO2中若有4NA对共用电子对形成时,放出1 300 kJ的能量
查看答案和解析>>
科目: 来源: 题型:
A.位于短周期X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的最高化合价X<Y
B.pH=2的盐酸和醋酸溶液各10 mL分别加水稀释到
C.二氧化硅晶体中,每个硅原子与2个氧原子形成共价键
D.在晶体中只要有阳离子就一定有阴离子
查看答案和解析>>
科目: 来源: 题型:
A.碳酸氢钠溶液中加入过量的石灰水:Ca2++2![]() +2OH-
+2OH-![]() CaCO3↓+
CaCO3↓+![]() +2H2O
+2H2O
B.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O![]()
![]() +4
+4![]() +2H2O
+2H2O
C.苯酚钠溶液中通入少量二氧化碳:![]()
D.钠与水反应:2Na+2H2O![]() 2Na++2OH-+H2↑
2Na++2OH-+H2↑
查看答案和解析>>
科目: 来源: 题型:
A.稀硫酸 B.饱和CuSO4溶液
C.NaCl溶液 D.饱和Na2CO3溶液
查看答案和解析>>
科目: 来源: 题型:
元素代号 | X | Y | Z | L | M | Q |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
下列说法中,正确的是
A.在化学反应中,M原子既不容易失去电子,又不容易得到电子
B.等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
C.Y与Q形成的化合物不可能跟氢氧化钠溶液反应
D.Z的氢化物的稳定性强于L的氢化物的稳定性
查看答案和解析>>
科目: 来源: 题型:
A.做温度对化学平衡影响的实验,将装有NO2与N2O4混合气体的两个玻璃球一个浸入热水,另一个浸入冷水,浸入热水的玻璃球里气体的颜色较浅
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2—3滴即可
D.向CuSO4溶液中滴入过量NaOH溶液充分反应后,倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物质为蓝色固体
查看答案和解析>>
科目: 来源: 题型:
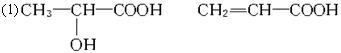
试回答下列问题:
(1)写出A、B、E的结构简式
A_________________,B_________________,E_________________。
(2)指出反应①、③的反应类型
①_________________ ③_________________
(3)写出下列反应的化学方程式:
反应④:___________________________________________________;
C的某种同分异构体(官能团与C相同)的氧化产物与银氨溶液的反应:_________________。
查看答案和解析>>
科目: 来源: 题型:
请回答:

(1)mg应为_____________极的质量增重(填A或B),电解总反应的离子方程式为_________________;
(2)测定m g数据时,同学们称量电解前电极的质量,电解后,用蒸馏水小心冲洗电极,烘干后再称量电极质量。你认为在上述实验过程中,至少要称量电极_________________次;
(3)本实验(电解CuSO4溶液)中,学习小组采用两套方案测定铜的相对原子质量:
①第一套方案中,同学们测得气体的体积为V L(标准状况),则铜的相对原子质量是_______________(用m、V表示);
②第二套方案中,需要测定的数据是_________________,简述采用此方案测定铜的相对原子质量的原理:_________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
①写出该反应的化学方程式:___________________________________________________;
②上述反应中生成0.1 mol还原产物时,转移电子的物质的量是_________________mol;
③由单质与氧气反应生成
(2)控制变量是科学研究中的重要研究方法,其基本思路是,在实验研究中人为只改变一个因素(调节变量),其他因素保持相同,观察测定因调节变量改变而改变的因素(因变量),从而分析得到研究结论。中学化学中应用控制变量的方法研究问题的例子很多。请分析或设计:
①在研究浓度对化学反应速率的影响时,教材安排了利用Na2S2O3与H2SO4反应的一组对照实验(Na2S2O3+H2SO4![]() Na2SO4+S↓+SO2↑+H2O)。
Na2SO4+S↓+SO2↑+H2O)。
烧杯编号 | 加3%Na2S2O3溶液体积(mL) | 加H2O体积(mL) | 加(体积比为1∶20)H2SO4溶液体积(mL) | 所需时间(s) |
1 | 5 | 5 | 2 |
|
2 | 7 | 3 | 2 |
|
3 | 10 | 0 | 2 |
|
在三个烧杯(底部有黑色“+”字标记)内分别加入表中所示体积的三种液体,搅拌并开始计时,到出现浑浊使烧杯底部“+”字看不见时停止计时。比较所需时间,得出浓度对化学反应速率影响的结论。实验中,温度和反应体系中硫酸浓度是保持相同的因素,调节变量是_________________,因变量是_________________。
②运用控制变量原理设计实验,利用纯碱溶液探究温度对盐的水解的影响,简述实验方法:
__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com