
科目: 来源: 题型:
A.将少量SO2气体通入NaClO溶液中:SO2+H2O+ClO-![]()
![]() +Cl-+2H+
+Cl-+2H+
B.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+![]() Ca2++2H2O
Ca2++2H2O
C.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+![]() +H++
+H++![]()
![]() BaSO4↓+NH3·H2O+H2O
BaSO4↓+NH3·H2O+H2O
D.苯酚钠溶液中通入CO2: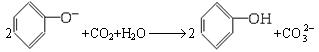
查看答案和解析>>
科目: 来源: 题型:
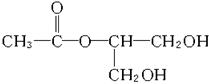
A.与氢氧化钠水溶液共热反应
B.与H2发生加成反应
C.与甲酸在一定条件下发生酯化反应
D.与新制银氨溶液共热反应
查看答案和解析>>
科目: 来源: 题型:
CO(g)+H2O(g)![]() H2(g)+CO2(g)ΔH>0当反应达平衡时,测得容器中各物质的物质的量均为n mol,欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施可以采用的是
H2(g)+CO2(g)ΔH>0当反应达平衡时,测得容器中各物质的物质的量均为n mol,欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施可以采用的是
A.升高温度 B.再通入n mol CO和n mol H2O
C.通入n mol H2 D.再通入2n mol CO2和2n mol H2
查看答案和解析>>
科目: 来源: 题型:
①将水沿着烧杯内壁缓缓加入浓硫酸中,并用玻璃棒不断搅拌。
②给试管中液体加热时,将试管与桌面成45°角倾斜,再集中于药品处加热。
③取用金属Na或K时,用剩的药品放回原瓶。
④用小试管收集氢气检验其纯度时听到爆鸣声,立即用此小试管重新收集氢气检验。
⑤取用少量白磷时,将白磷放到滤纸上切割,用剩的白磷立即放回原瓶
A.全部 B.①②④⑤ C.①③⑤ D.①④
查看答案和解析>>
科目: 来源: 题型:
A.干冰、双氧水、碳酸钠晶体、醋酸
B.氨水、水煤气、氢氧化镁、次氯酸
C.福尔马林、空气、氢氧化钠、硫氰化铁
D.明矾、漂白粉、苛性钾、硫酸钡
查看答案和解析>>
科目: 来源: 题型:

(1)若甲是中学化学中常见的红棕色粉末状固体,则单质A与NaOH溶液反应的离子方程式为________________;A与甲反应在工业上一个重要用途是________________。
(2)若乙的水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出乙在水溶液中发生电离时的电离方程式:________________;丙与乙反应的化学方程式:________________。
(3)若乙的水溶液呈弱碱性,并可用作农业化肥,D通常状况下为气体,则进行下列研究:现将0.40 mol C和0.20 mol D充入

①若t1=10 min,则0至t1时间内C物质的平均反应速率为________________;该反应在t2时达到平衡,其化学反应方程式为________________。
②根据图中曲线变化情况判断,t1时刻改变的反应条件可能是________________。
a.加入了催化剂
b.降低了反应的温度
c.向容器中又充入了气体D
查看答案和解析>>
科目: 来源: 题型:
(1)写出A、C、E三种元素的名称。
A.________________;C________________.;E. ________________。
(2)A、B形成的化合物与DB2反应生成一种强酸的化学方程式为________________。
(3)已知DB2在一定条件下可转化为DB3,1 mol DB2充分反应,放出98.3 kJ的热量,该反应的热化学方程式是________________,工业上进行这一反应的设备是,反应的适宜条件为________________。
(4)用铂作电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为________________;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是________________;若改用铁棒作阳极材料,则阳极的电极反应式为________________。
查看答案和解析>>
科目: 来源: 题型:
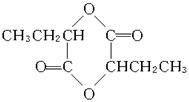
(1)A的结构简式是________________;C的结构简式是________________。
(2)A分子中含有官能团名称是________________、________________。
(3)A可以在一定条件下自身聚合形成一种高分子化合物,写出该聚合物的结构简式________________。
(4)A在一定条件下可脱去一分子水,形成能使溴的四氯化碳溶液褪色的化合物F,F的结构简式是________________。
(5)A与乙酸在一定条件下反应的化学方程式是________________。
查看答案和解析>>
科目: 来源: 题型:
请回答下列问题:
(1)从以下仪器中选出本实验不需要使用的仪器(用字母填写)________________。
A.托盘天平 B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚 H.干燥器 I.泥三角 J.石棉网 K.三脚架 L.药匙 M.坩埚钳
(2)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?
答:________________________________________________________________。
(3)做此实验,至少应进行称量操作________________次,至少加热________________次。
(4)实验步骤⑥的目的是______________________________________。
(5)实验后得到以下数据:
①加热前质量:W1(容器),W2(容器+晶体);②加热后质量:W3(容器+无水硫酸铜)。
请写出硫酸铜晶体中结晶水含量,用质量分数表示的计算式(含W1、W2、W3)为:________________。
(6)若操作正确但实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有________________。
A.被测样品中含有加热不挥发的杂质
B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水
D.加热前所用的坩埚未完全干燥
查看答案和解析>>
科目: 来源: 题型:
CH3—CH=CH—CH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为![]() ,下列说法中,不正确的是
,下列说法中,不正确的是
A.X的化学式为C8H8
B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C.X能使酸性高锰酸钾溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com