
科目: 来源: 题型:
A.氢氧化亚铁固体加入足量的稀硝酸中:Fe(OH)2+2H+![]() Fe2++2H2O
Fe2++2H2O
B.NaHCO3的水解:![]() +H2O
+H2O![]() H3O++
H3O++![]()
C.用碳酸钠溶液吸收少量二氧化硫:2![]() +SO2+H2O
+SO2+H2O![]() 2
2![]() +
+![]()
D.硫酸铝溶液中加入过量氨水:Al3++3OH-![]() Al(OH)3↓
Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
A.NO2在紫外线照射下,会发生一系列光化学反应,产生有毒的光化学烟雾
B.pH在5.6—7.0之间的降水通常称为酸雨
C.合成材料废弃物造成了严重的环境问题,“白色污染”即是其中最突出的例子
D.废旧电池渗出的重金属离子会造成地下水和土壤的污染
查看答案和解析>>
科目: 来源: 题型:
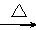
(1)A的名称________________________________。
(2)写出B→C的化学方程式________________________________。
(3)检验B或D可选用同一种试剂,且加热反应后都有红色沉淀生成,写出D与这种试剂反应的化学方程式________________________________________________。
(4)写出所有比G少一个碳原子的G的同系物的结构简式___________________。
(5)反应①、②、③中,与反应④类型相同的是________________(填序号)。
(6)写出实验室中制取G后,提纯并分离G的操作方法________________。
查看答案和解析>>
科目: 来源: 题型:
回答下列问题:

(1)若要检验该产物中是否存在亚硫酸钠,你设计的实验方案是___________________。
(2)若要进一步检验该产物中是否存在硫酸钠,请你简述操作方法______________________。
(3)若实验前测得Na2O2的质量为m1 g,实验后冷却至室温,测得固体的质量为m2g,请你从定量测定的角度分析,当两种产物都有时,m2的取值范围是(用m1来表示) ________________。该试样中亚硫酸钠的质量分数的计算式为(用m1、m2来表示) ____________________。
(4)取m g上述反应后的固体,请你简述一种实验方法测定该试样中亚硫酸钠的质量分数:
________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
途径 | 生成1 mol Al(OH)3消耗H+或OH-的物质的量/mol |
|
| 消耗H+ | 消耗OH- |
1.Al→Al3+→Al(OH)3 | 3 | 3 |
2.Al→ | 1 | 1 |
|
|
|
(1)制备相同物质的量的Al(OH)3消耗酸和碱最少的方案是______________(填序号);按此方案,每制备1 mol Al(OH)3,理论上至少消耗H2SO4____________mol,NaOH_______________mol。
(2)有同学按课本方案3进行试验,将铝粉(未被氧化)以1∶3质量比分别溶于酸、碱溶液中,结果发现不但耗酸量和耗碱量都大于理论用量,且生成的Al(OH)3也大大减少,你认为产生此结果的原因可能是________________________________________________。
(3)该同学根据方案3中Al全部转入Al(OH)3,溶液中只有Na2SO4这一事实,设计了不用天平,只用量筒就可使Al完全转化为Al(OH)3,且酸碱的利用率达到最大的方案,请你分析该同学所取NaOH溶液和H2SO4溶液中溶质的物质的量之比为________________;所加Al粉的量为________________(填“少量”或“过量”);请你写出后续实验步骤________________。
查看答案和解析>>
科目: 来源: 题型:
(1)写出具有18个电子的A的氢化物的电子式_______________;写出一种具有三角锥形结构的BC3分子的化学式_______________。
(2)写出在BC3溶液中B3+离子与过量NaOH溶液反应的离子方程式_______________。
(3)写出D的单质与具有10个电子的A的氢化物在一定条件下反应的化学方程式_______________。
(4)向含有D的某种离子的溶液中加KSCN溶液后无明显现象,但再滴加A的某种氢化物后,溶液也变为红色,请写出此种D离子在酸性条件下与此种A的氢化物发生反应的离子方程式_____________________________________________。
(5)若向题中含有D的某种离子的溶液中,加入NaOH溶液,观察到的现象是。有关离子方程式或化学方程式是_______________、_______________。
查看答案和解析>>
科目: 来源: 题型:
A.氢气的摩尔质量和阿伏加德罗常数
B.氢气分子的体积和氢气分子的质量
C.氢气的摩尔质量和氢气的摩尔体积
D.氢气分子的质量和氢气的摩尔体积及阿伏加德罗常数
查看答案和解析>>
科目: 来源: 题型:
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学键时放出的能量 | 436 kJ·mol-1 | 243 kJ·mol-1 | 431 kJ·mol-1 |
则下列热化学方程式不正确的是
A.![]() H2(g)+
H2(g)+![]() Cl2(g)
Cl2(g)![]() HCl(g);ΔH=-91.5 kJ·mol-1
HCl(g);ΔH=-91.5 kJ·mol-1
B. ![]() H2(g)+
H2(g)+![]() Cl2(g)
Cl2(g)![]() HCl(g);ΔH=+91.5 kJ·mol-1
HCl(g);ΔH=+91.5 kJ·mol-1
C.H2(g)+Cl2(g)![]() 2HCl(g);ΔH=-183 kJ·mol-1
2HCl(g);ΔH=-183 kJ·mol-1
D.2HCl(g)![]() H2(g)+Cl2(g);ΔH=+183 kJ·mol-1
H2(g)+Cl2(g);ΔH=+183 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
A.该温度高于
B.由水电离出来的c(H+)=1×10-10 mol/L
C.c(H+)=c(OH-)+c(![]() )
)
D.该温度下,在上述溶液中加入等体积的pH=12的NaOH溶液,溶液恰好呈中性
查看答案和解析>>
科目: 来源: 题型:
A.常温下,由水电离出c(H+)=10-14 mol/L的溶液中:Na+、![]() 、Cl-、
、Cl-、![]()
B.能使pH试纸呈现红色的溶液:Fe2+、K+、![]() 、Na+
、Na+
C.![]() 可以大量存在的溶液:Ag+、K+、
可以大量存在的溶液:Ag+、K+、![]() 、Al3+
、Al3+
D.常温下,pH=2的溶液中:![]() 、K+、
、K+、![]() 、Al3+
、Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com