
科目: 来源: 题型:
A.只要在室内放一盆水
B.向地势低的地方撤离
C.观察风向,顺风撤离
D.用湿毛巾或蘸有石碱水的毛巾捂住口鼻撤离
查看答案和解析>>
科目: 来源: 题型:
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧衍生物
A.②④ B.②③ C.①③ D.①④
查看答案和解析>>
科目: 来源: 题型:
①铝合金是阳极 ②铝合金是负极 ③海水是电解液 ④铝合金电极发生还原反应
A.②③ B.②④ C.①③ D.①④
查看答案和解析>>
科目: 来源: 题型:
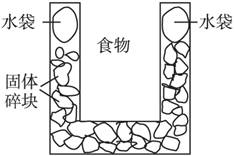
A.硝酸铵 B.生石灰 C.氯化镁 D.食盐
查看答案和解析>>
科目: 来源: 题型:阅读理解
考生必须从中选择1道题作答。
1.【化学—化学与技术】金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
请回答下列问题:
(1)冰晶石(Na3AlF6)的作用是___________________。
(2)电解生成的金属铝是在熔融液的______________(填“上层”或“下层”)。
(3)阴极和阳极均由______________材料做成;电解时不断消耗的电极是___________(填“阳极”或“阴极”)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成______________(填代号)。
a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
2.【化学—物质结构与性质】
C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式______________。从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为______________。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为______________,微粒间存在的作用力是______________。
(3)氧化物MO的电子总数与SiC的相等,则M为______________(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是_________________________。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键。___________。
3.【化学—有机化学基础】
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。

请根据上述信息回答:
(1)H中含氧官能团的名称是____________,B→I的反应类型为____________。
(2)只用一种试剂鉴别D、E、H,该试剂是____________。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为____________。
(4)D和F反应生成X的化学方程式为____________________________________。
查看答案和解析>>
科目: 来源: 题型:

请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择。“实验步骤中试剂①为___________(填代号),检验溶液A中Fe3+的最佳试剂为______________(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、___________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是________________。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)___________(填化学式)。若实验过程中有氨气逸出,应选用下列___________装置回收(填代号)。

(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应___________,直到___________。用KMnO4标准溶液滴定时应选用___________滴定管(填“酸式”或“碱式”)。
查看答案和解析>>
科目: 来源: 题型:
(1)该电池的负极材料是__________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。欲除去Cu2+,最好选用下列试剂中的___________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是__________。若电解电路中通过2 mol电子,MnO2的理论产量为__________ g。
查看答案和解析>>
科目: 来源: 题型:
(1)合成氨反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
(2)已知:O2(g)====![]() (g)+e- ΔH1=1 175.7 kJ·mol-1
(g)+e- ΔH1=1 175.7 kJ·mol-1
PtF6(g)+e-====![]() ΔH2=-771.1 kJ·mol-1
ΔH2=-771.1 kJ·mol-1
![]() ====
====![]() (g)+
(g)+![]() ΔH3=482.2 kJ·mol-1
ΔH3=482.2 kJ·mol-1
则反应O2(g)+FtF6(g)====![]()
![]() 的ΔH=___________ kJ·mol-1。
的ΔH=___________ kJ·mol-1。
(3)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________________________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(![]() )=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com