
科目: 来源: 题型:阅读理解
Ⅰ.测定过氧化氢的含量
请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL_________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
![]()
![]() +
+![]() H2O2+
H2O2+![]() H+====
H+====![]() Mn2++
Mn2++![]() H2O+
H2O+![]()
(3)滴定时,将高锰酸钾标准溶液注入____________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是__________________________________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
实验内容 | 实验方法 | 实验现象 |
验证氧化性 |
|
|
验证不稳定性 |
|
|
查看答案和解析>>
科目: 来源: 题型:

下列说法正确的是( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目: 来源: 题型:
A.c(![]() ):③>①
):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
A. ![]()
B.![]()
C.n=m+17Vc
D.![]()
查看答案和解析>>
科目: 来源: 题型:
A.还原性:X的氢化物>Y的氢化物>Z的氢化物
B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.YX2、M2Y都是含有极性键的极性分子
D.Z元素的最高价氧化物的水化物的化学式为HZO4
查看答案和解析>>
科目: 来源: 题型:
A.2H+(aq)+![]() (aq)+Ba2+(aq)+2OH-(aq)====BaSO4(s)+2H2O(l);ΔH=-57.3 kJ/mol
(aq)+Ba2+(aq)+2OH-(aq)====BaSO4(s)+2H2O(l);ΔH=-57.3 kJ/mol
B.KOH(aq)+![]() H2SO4(aq)====
H2SO4(aq)====![]() K2SO4(aq)+H2O(l);ΔH=-57.3 kJ/mol
K2SO4(aq)+H2O(l);ΔH=-57.3 kJ/mol
C.C8H18(l)+![]() O2(g)====8CO2(g)+9H2O(g);ΔH=-5 518 kJ/mol
O2(g)====8CO2(g)+9H2O(g);ΔH=-5 518 kJ/mol
D.2C8H18(g)+25O2(g)====16CO2(g)+18H2O(l);ΔH=-5 518 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
A.无色溶液:Ca2+、H+、Cl-、![]()
B.能使pH试纸呈红色的溶液:Na+、![]() 、I-、
、I-、![]()
C.FeCl2溶液:K+、Na+、![]() 、
、![]()
D.![]() 的溶液:Na+、K+、
的溶液:Na+、K+、![]() 、
、![]()
查看答案和解析>>
科目: 来源: 题型:

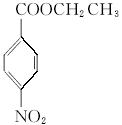
请回答下列问题:
(1)写出A、B、C的结构简式:A___________、B___________、C___________。
(2)用1H核磁共振谱可以证明化合物C中有________种氢处于不同的化学环境。
(3)写出同时符合下列要求的化合物C的所有同分异构体的结构简式(E、F、G除外)_______。
①化合物是1,4-二取代苯,其中苯环上的一个取代基是硝基
②分子中含有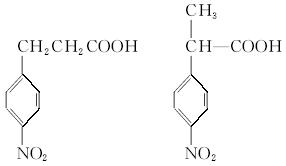 结构的基团
结构的基团
注:E、F、G结构如下:
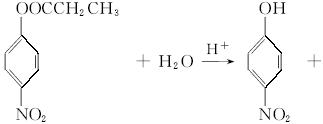
(4)E、F、G中有一化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,写出该水解反应的化学方程式_____________________。
(5)苄佐卡因(D)的水解反应如下:
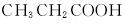
![]()
化合物H经聚合反应可制成高分子纤维,广泛用于通讯、导弹、宇航等领域。请写出该聚合反应的化学方程式_________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl下标5 |
沸点/℃ | 57.7 | 12.8 | — | 315 | — |
熔点/℃ | -70.0 | -107.2 | — | — | — |
升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式____________。
(2)装置A中g管的作用是____________;装置C中的试剂是;装置E中的h瓶需要冷却的理由是____________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO-4+8H+====5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由__________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
2NO+2CO![]() 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 |
c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 |
c(CO)/ mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 |
| |||
时间/s | 3 | 4 | 5 |
c(NO)/mol·L-1 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/ mol·L-1 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的ΔH________0(填写“>”、“<”、“=”)。
(2)前2 s内的平均反应速率v(N2)=________。
(3)在该温度下,反应的平衡常数K=________。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | NO初始浓度/ mol·L-1 | CO初始浓度/mol·L-1 | 催化剂的比表面积/ m2·g-1 |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ |
|
|
| 124 |
Ⅲ | 350 |
|
| 124 |
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com