
科目: 来源: 题型:
①江河入海口三角洲的形成通常与胶体的性质有关
②四川灾区重建使用了大量钢材,钢材是合金
③“钡餐”中使用的硫酸钡是弱电解质
④太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
⑤常用的自来水消毒剂有氯气和二氧化氯,两者都含有极性键
⑥水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物
A.①②③④ B.①②④⑥
C.①②⑤⑥ D.③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
A.天然气和沼气的主要成分是甲烷
B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
C.纤维素乙酸酯、油脂和蛋白质在一定条件下都能水解
D.葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物
查看答案和解析>>
科目: 来源: 题型:
A.可用25 mL碱式滴定管量取20.00 mL KMnO4溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
查看答案和解析>>
科目: 来源: 题型:
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得 Fe、Co、K、Au、Mg、B等金属
查看答案和解析>>
科目: 来源: 题型:阅读理解
A.生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式_________________________。
(2)根据等电子原理,写出CO分子的结构式______________________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是_____________________;甲醛分子中碳原子轨道的杂化类型为_____________________。
②甲醛分子的空间构型是_____________________;1 mol甲醛分子中σ键的数目为_____________________。

③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为_____________________。
B.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:

环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3, | 溶解性 |
环己醇 | 161.1(97.8)* | 0.962 4 | 能溶于水 |
环己酮 | 155.6(95)* | 0.947 8 | 微溶于水 |
水 | 100.0 | 0.998 2 |
|
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55~
①酸性Na2Cr2O7溶液的加料方式为_____________________。
②蒸馏不能分离环己酮和水的原因是_____________________。
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~
①上述操作的正确顺序是_______________________(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需_______________。
③在上述操作c中,加入NaCl固体的作用是_______________________________________
______________________________________________________________________________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有______________种不同化学环境的氢原子。
查看答案和解析>>
科目: 来源: 题型:
(1)已知:2NO2(g)====N2O4(g) ΔH=-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) ![]() N2O4(g)达到平衡。
N2O4(g)达到平衡。
其他条件不变时,下列措施能提高NO2转化率的是______________(填字母)。
A.减小NO2的浓度
B.降低温度
C.增加NO2的浓度
D.升高温度
(2)
(3)![]() N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
(4)现用一定量的Cu与足量的浓HNO3反应,制得
查看答案和解析>>
科目: 来源: 题型:
![]()
![]()

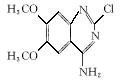

![]()

![]()
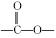
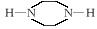
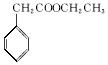
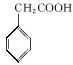
(1)写出D中两种含氧官能团的名称:___________________和___________________。
(2)写出满足下列条件的D的一种同分异构体的结构简式___________________________
____________________________________________________________________________。
①苯的衍生物,且苯环上的一取代产物只有两种;②与Na2CO3溶液反应放出CO2气体;③水解后的产物才能与FeCl3溶液发生显色反应。
(3)E→F的反应中还可能生成一种有机副产物,该副产物的结构简式为___________________。
(4)由F制备多沙唑嗪的反应中要加入试剂X(C10H10N3O2Cl),X的结构简式为______________________________________________________________________________。
(5)苯乙酸乙酯是一种常见的合成香料。请设计合理的方案以苯甲醛和乙
醇为原料合成苯乙酸乙酯(用合成路线流程图表示,并注意反应条件)。
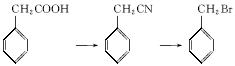
提示:①R—Br+NaCN![]() R—CN+NaBr;②合成过程中无机试剂任选;③合成路线流程图示例如下:
R—CN+NaBr;②合成过程中无机试剂任选;③合成路线流程图示例如下:
CH3CH2OH![]() H
H![]()
查看答案和解析>>
科目: 来源: 题型:阅读理解
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl====2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4====2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_____________________。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(![]() )。2001年我国卫生部规定,饮用水中
)。2001年我国卫生部规定,饮用水中![]() 的含量应不超过0.2 mg·L-1。
的含量应不超过0.2 mg·L-1。
饮用水中ClO2、![]() 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为![]() 、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,![]() 也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:

2Na2S2O3+I2====Na2S4O6+2NaI
①请写出pH≤2.0时,![]() 与I-反应的离子方程式___________________________________。
与I-反应的离子方程式___________________________________。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL。
步骤5:_________________________________。
步骤6:再用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水样中![]() 的浓度为________________mol·L-1 (用含字母的代数式表示)。
的浓度为________________mol·L-1 (用含字母的代数式表示)。
④若饮用水中![]() 的含量超标,可向其中加入适量的Fe2+将
的含量超标,可向其中加入适量的Fe2+将![]() 还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是_______(填字母)。
A.热裂解形成燃油
B.露天焚烧
C.作为有机复合建筑材料的原料
D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+ (aq)====Cu2+ (aq)+H2(g) ΔH=64.39 kJ·mol-1
2H2O2(l)====2H2O(l)+O2(g) ΔH=-196.46 kJ·mol-1
![]() ====H2O(l) ΔH=-285.84 kJ·mol-1
====H2O(l) ΔH=-285.84 kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_____________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol·L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率/×10-3 mol·L-1·min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com