
科目: 来源: 题型:
为了配制100 mL 2 mol?L-1的NaOH溶液,有下列几项操作,其中错误的是( )
①NaOH固体放在纸上用天平称量
②选用用蒸馏水洗净的100 mL容量瓶进行配制(容量瓶中有少量蒸馏水)
③NaOH在烧杯里刚完全溶解,立即把溶液转移到容量瓶中
④用蒸馏水洗涤烧杯和玻璃棒两次,洗涤液都注入容量瓶中
⑤使蒸馏水沿着玻璃棒注入容量瓶,直到凹液面恰好与刻度线相切
A.①②③苯 B.③④⑤
C.②③⑤ D.①③⑤
查看答案和解析>>
科目: 来源: 题型:
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2―3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2―3次
查看答案和解析>>
科目: 来源: 题型:阅读理解
I某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cr、OH-、HCO![]() 、NO
、NO![]() 。已知该溶液可与Al2O3反应,则:
。已知该溶液可与Al2O3反应,则:
(1)该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有 ,
一定不会含有大量的 。
(2)该溶液与Al2O3反应后有【Al(OH)4】生成,则原溶液中一定含有 ,可能含有
大量的 。
(3)写出该溶液与Al2O3反应生成【Al(OH)4】的离子方程式 。
Ⅱ. 研究性学习小组的同学为了了解Cu及其化合物的性质,提出以下问题;
①Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②Fe的+2价化合物的稳定性比+3价化合物的稳定性小,Cu的+l价化合物的稳定性也比+2价化合物的稳定性小吗?
③CuO能被H2、CO等还原,也能被NH3还原吗?
(1)解决问题①需要用到的药品有CuSO4溶液、 (填字母)。
A.AlCl3溶液 B.NaOH溶液 C.稀H2SO4 D.H2O2溶液
假若Cu(OH)2具有两性,应该看到的实验现象是
。
(2)为了比较Cu的+1价化合物和+2价化合物的稳定性,他们取98gCu(OH)2固体,加热至800℃~1000℃时,得到黑色固体粉末,继续加热到1 000℃以上,黑色粉末全部变成红色粉末X。冷却后称量,X的质量为72g。向X中加入过量稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。据此可推得,X的化学式为 ,可以得出的结论是
。
(3)为解决问题③,设计了如下的实验装置(夹持及尾气处理装置未画出):
在实验中观察到CuO变成红色物质,无水CuSO4变成蓝色,生成物中还有一种无污染的单质气体。装置A的作用是 ,B中发生反应的化学方
程式为 。

查看答案和解析>>
科目: 来源: 题型:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一。
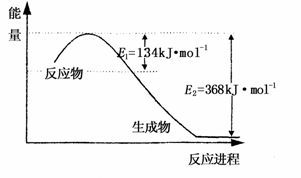
(1)上图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 ;
又知:N2 (g)+O2 (g)=2 NO(g) △H=+180kJ?mol-1;
2NO(g)+ O2(g)=2NO2(g) △H=-112.3 kJ?mol-1;
则反应:2NO(g)+2CO2(g) ![]() N2(g)+2CO2(g)的△为 ;
N2(g)+2CO2(g)的△为 ;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2(g)+O2 (g) ![]() 2 N2O5(g);已知体系中n(NO2)随时间变化如下表:
2 N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
①写出该反应的平衡常数表达式:K= ,已知:K300℃>K350℃,则该反应是 热反应
②反应达到平衡后,NO2的转化率为 ,此时若再通入一定量氮气,则NO2
的转化率将 (填“增大”、“减小”、“不变”);
③右图中表示N2O5 的浓度的变化曲线是 ,
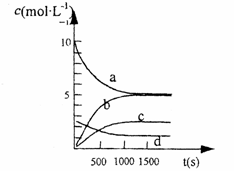
用O2表示从0~500 s内该反应的平均速率v= 。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),
其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色;反应③中有水生成,反应②需要放电才能发生,A和 D相遇有白烟生成。
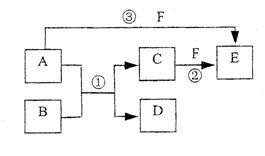
(1)反应③的化学方程式为 ;
(2)反应①中每生成1 mol C,转移的电子数为 ;
(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈 性(填“酸”“碱”或“中”),
该水溶液中存在着如下关系,用粒子浓度符号填写:
①c(H+)+ =c(OH-)+ ;
②c(H+)=c(OH-)+ 。
(4)元素x与组成B的元素同周期,x的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式 ;
②X、空气、海水可以绢.成新型海水标志灯的电池。该种灯以海水为电解质溶液,靠空气中的氧气
使X不断氧化而源源不断产生电流,只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍。则该新型电池的正极的电极反应式为 ;
原电池的总反应方程式为 。
查看答案和解析>>
科目: 来源: 题型:
几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,正确的是
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、4 | -2 |
A.等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
B.Y与Q形成的化合物不可能跟氢氧化钠溶液反应
C.Z的氢化物的稳定性强于L的氢化物的稳定性
D.在化学反应中,M原子与其它原子易形成共价键而不易形成离子键
查看答案和解析>>
科目: 来源: 题型:
下列说法中,正确的是
A.0.1 mol?L-1 的 醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小
B.体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少
C.若常温下H+(aq)+OH-(aq)=H2O(l)△H =-573kJ?mol-1,则
H+ (aq)+ NH3?H2O(aq)=NH![]() (aq)+H2O(l)△H=-57.3kJ?mol-1
(aq)+H2O(l)△H=-57.3kJ?mol-1
D.少量NaHSO4溶液与足量Ba(OH)2溶液反应离子方程式为:
2H++SO![]() +Ba2++2OH-=BaSO4↓+2H2O
+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目: 来源: 题型:
右图为一原电池的结构示意思,下列说法中,不正确的是
A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu ,该反应一定为放热反应
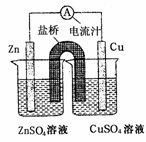
B.原电池工作时,Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
D.如果将Cu电极改为Fe电极,Zn电极依然作负极
查看答案和解析>>
科目: 来源: 题型:
若NA代表阿伏加德罗常数,则下列说法中,正确的是
A.22.4L HBr气体中,含有NA对共有电子
B.在SiO2+2C![]() Si+2CO↑的反应中,每当有1mol气体生成,就有4N4 个电子转移
Si+2CO↑的反应中,每当有1mol气体生成,就有4N4 个电子转移
C.在1L明矾[KAl(SO4)2?12H2 O]溶液中,若n(Al3+)=0.2 NA时,则c(SO![]() )>0.4mol?L-1
)>0.4mol?L-1
D.分别处于第二、三周期的两种元素的原子各1mol,其最外层电子数最多相差8NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com