
科目: 来源: 题型:
对下列实验现象的分析,结论正确的是( )
| 编号 | 实验现象 | 结论 | |
| A | 甲溶液中加入氯化钡、稀硝酸的混合液 | 产生白色沉淀 | 甲溶液中一定有SO |
| B | 乙溶液进行焰色反应 | 焰色呈黄色 | 乙一定是钠盐溶液 |
| C | 丙溶液中加入硝酸银、稀硝酸的混合液 | 产生白色沉淀 | 丙溶液中一定有Cl? |
| D | 把湿润的碘化钾淀粉试纸放入红棕色的丁气体中 | 试纸变蓝色 | 丁不一定是溴蒸气 |
查看答案和解析>>
科目: 来源: 题型:
水处理技术在工业生产和日常生活中有着重要应用。
(1)水处理絮凝剂包括无机絮凝剂和有机絮凝剂。无机絮凝剂如明矾,其原理用离子方程式表示为 ;有机絮凝剂如聚丙烯酸钠,其结构简式为 。
(2)用氯气进行自来水消毒时,起消毒杀菌作用的物质是 ,但用氯气消毒的水可能有臭味,长期饮用还可能对人造成潜在危害。ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,工业上可用SO2与NaClO3溶液反应制得,该反应中氧化剂与还原剂的物质的量之比是___________。
(3)高铁酸钠(Na2FeO4)作为水处理剂兼具絮凝剂和消毒杀菌剂的作用,被科学家们公认为绿色消毒剂。
① 实验室采用次氯酸盐氧化法制高铁酸钠,在10.0 mL质量分数为8 % 的次氯酸钠溶液(密度为1.05 g?cm-3)中加入4.0 g氢氧化钠和0.70 g硫酸铁,可制备高铁酸钠的稀溶液,该反应的离子方程式是 ,所得溶液中含高铁酸钠最多只能达到________ mol。
② 高铁酸盐还可用于可充电电池。高铁电池与普通高能电池相比,能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O ![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
该电池充电时,阳极的电极反应是 ;放电时,每有1 mol K2FeO4被还原,转移电子的数目为 。
查看答案和解析>>
科目: 来源: 题型:
芳香族化合物A只有两个对位取代基,在一定条件下有如下图所示转化关系。其中,1 mol C与Na完全反应生成1 mol H2,若1 mol C与NaHCO3完全反应,也产生1 mol气体,E可以使溴的四氯化碳溶液褪色。
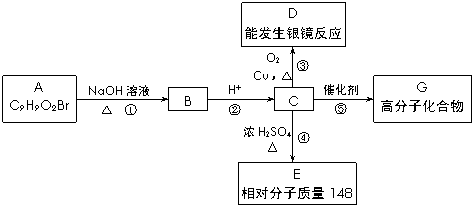 |
(1)D分子中的含氧官能团名称是 ,A的结构简式是 。
(2)反应④的基本类型是 反应,反应⑤的化学方程式是 。
(3)与C取代基位置相同,既能与FeCl3溶液显色、又能发生水解反应的同分异构体结构简式为:![]() 、
、![]() 、 。
、 。
(4)现有C和E的混合物n mol,在空气中完全燃烧消耗O2 L(标准状况),若生成CO2 a L(标准状况)、H2O b g,则C、E混合物中含E的物质的量的计算式为:
。
查看答案和解析>>
科目: 来源: 题型:
如下图所示的转化关系中(部分产物省略),A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒。
 |
![]()
请回答下列问题:
(1)J的化学式为 ,Y的电子式为 。
(2)反应③的离子方程式是 ,反应⑤的化学方程式是 。
(3)上述转化中,属于氧化还原反应的是(填编号) 。
(4)在450 ℃、催化剂存在下,4 mol F和2 mol O2反应放热353.9 kJ,此时,F的转化率为90 %,则该反应的热化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
已知,室温下存在反应3HNO2===HNO3+2NO↑+H2O;在酸性溶液中,NO![]() 可将 MnO
可将 MnO![]() 还原为Mn2+且无气体生成。某化学兴趣小组设计了如下探究实验:
还原为Mn2+且无气体生成。某化学兴趣小组设计了如下探究实验:

请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是 。
(2)B瓶中可以观察到的现象是 ,C瓶出来的气体是 。
(3)实验时观察到D 管内固体颜色逐渐变为白色。据此甲同学认为D管中生成物是NaNO3,而乙同学则认为D管中生成的是NaNO2,如何证明乙同学的观点正确?
| 实验方法 | 实验现象 | 反应的离子方程式 |
(4)E装置的作用是 。
(5)同学们经讨论认为上述装置仍有缺陷,为了避免D管中生成NaOH,你认为应该进行的改进是 。
查看答案和解析>>
科目: 来源: 题型:
在高温和催化剂存在下,向容积为2 L的密闭容器加入0.2 mol CO和0.2 mol H2O,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);?H=-a kJ/mol(a>0)。达到平衡后,测得c(CO)∶c(CO2)=2∶3。下列说法正确的是
CO2(g)+H2(g);?H=-a kJ/mol(a>0)。达到平衡后,测得c(CO)∶c(CO2)=2∶3。下列说法正确的是
A. 反应放出的热量为0.2a kJ
B. 平衡时H2O的转化率为60 %
C. 升高温度,v(正) 加快v(逆) 减慢,平衡正向移动
D. 将容器的体积压缩为1 L,H2的体积分数变为60 %
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A. 将Ca(OH)2饱和溶液加热,溶液的pH和Kw均增大
B. 将0.1 mol/L的氨水加水稀释10倍后,溶液中所有的离子浓度均减小
C. 两种醋酸溶液物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合后,滴入石蕊溶液呈红色
查看答案和解析>>
科目: 来源: 题型:
一种适用于柑橘、苹果等作物的低毒杀螨剂“溴螨酯”,杀螨谱广、持续期长,对天敌、蜜蜂及作物均较安全,其结构如图所示。下列有关“溴螨酯”的说法错误的是
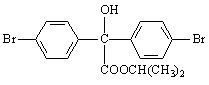 A. 分子中最多只有12个原子位于同一平面上
A. 分子中最多只有12个原子位于同一平面上
B. 既能发生水解反应,又能发生酯化反应
C. 不能与FeCl3溶液发生显色反应
D. 1 mol溴螨酯可与4 mol NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素。原子半径X<Y<W<R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之和相等。下列说法不正确的是
A. 工业上用电解法获得Z、R的单质
B. Y、Z、R的简单离子具有相同的电子层结构
C. 由X与Y、X与W形成的化合物放在空气中都易变质
D. 由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应
查看答案和解析>>
科目: 来源: 题型:
下列说法一定正确的是
A. 周期表中同主族元素单质的熔点从上到下逐渐增高
B. 12 g 金刚石与8 g CH4所含共价键数目相等
C. 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
D. 若将AlCl3溶液、Na2SO3溶液蒸干并灼烧可分别得到Al2O3和Na2SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com