
科目: 来源: 题型:
镁比铝元素的金属性强,以下说法不能说明这一点的是( )
A.氢氧化镁是中强碱而氢氧化铝具有两性
B.铝在冷的浓硫酸中钝化而镁不钝化
C.氯化镁的熔点比氯化铝的熔点高
D.镁能与沸水发生置换反应而铝不能
查看答案和解析>>
科目: 来源: 题型:
某实验小组欲用10 g胆矾制取氧化铜并证明氧化铜能加快氯酸钾的分解。
Ⅰ.请你完成他们制取氧化铜的实验步骤。
(1)稀取10 g胆矾,将其放入小烧杯中,再________________________________。
(2)向步骤(1)中的烧杯内滴加____________溶液,直至产生大量的沉淀。
(3)检验沉淀是否完全,操作方法是_______________________________。
(4)将步骤(2)所得混合物加热至沉淀全部变为___________色。
(5)再将步骤(4)所得混合物___________、洗涤、___________后研细;验证是否洗净沉淀中硫酸根离子的方法是______________________。
Ⅱ.请用下列实验装置证明氧化铜能加快约7%的双氧水的分解并与二氧化锰的催化效果进行比较(即比较反应速率)。用下图装置测量产生气体的体积,其他可能影响实验的因素均已忽略,相关数据如下:
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| ① | 15 mL | 无 | |
| ② | 15 mL | CuO(0.5 g) | |
| ③ | 15 mL | MnO2(0.5 g) |
(1)从设计原理看,实验中的“待测数据”可以指__________________________,也可以指___________________________________________________。
(2)实验时气体收集在B中,B仪器名称为____________。若要检验产生的气体是O2,待气体收集结束后,用弹簧夹夹住B下端乳胶管,打开单孔橡皮塞,________________________。
(3)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验(不必写具体操作):a.证明CuO的化学性质没有改变,b._____________________。
Ⅲ.为证明氧化铜的化学性质在加入双氧水前后没有发生改变,你设计验证的实验是:_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
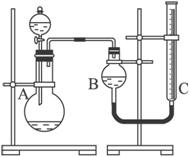
图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑和6 mol?L-1的硫酸,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是_________,A中反应的离子方程式是____________________________________。
(2)实验开始时应先将活塞E_________(填“打开”“关闭”或“无关系”),C中收集到气体的主要成分是___________________________。
(3)简述生成Fe(OH)2的操作过程____________________________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________________。
查看答案和解析>>
科目: 来源: 题型:
(1)下列有关实验的基本操作及安全知识的叙述,正确的是______________(填序号)。
A.附着于试管内壁的苯酚,可用碱液洗涤
B.用结晶法可以除去硝酸钾中混有的少量氯化钠
C.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
D.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
E.浓硫酸不小心沾到皮肤上,立刻用稀烧碱溶液洗涤
F.在氢氧化铁胶体中滴加少量稀硫酸会产生沉淀
(2)下表是某种常见金属的部分性质:
| 颜色状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色固体 | 较软 | 2.70 g?cm-3 | 660.4 ℃ | 良好 | 良好 | 良好 |
将该金属投入冷水中无变化,投入稀盐酸中可产生大量的无色气体。试回答:
①推断该金属可能的一种用途__________,该金属的活动性比铜__________(填“强”或“弱”)。
②请自选试剂,设计不同的实验探究该金属与铁的活动性强弱,并完成下表:
| 猜想 | 验证方法 | 预测实验现象 |
| 该金属比铁活泼 | ||
| 该金属活泼性比铁弱 |
查看答案和解析>>
科目: 来源: 题型:
(1)下列四种实验装置(根据需要可在其中加入液体或固体):
①能用于干燥二氧化硫气体的装置有__________(填字母)。
②装置B除可用于制取CO2、H2,还可制取__________、__________。(写出两种物质的化学式)
③既能用于收集氯气又能用于收集一氧化氮气体的装置有__________。(填字母)

(2)下列实验操作或实验事实的叙述不正确的是_____________(填序号)。
A.过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体
B.在试管中放入几片碎滤纸片,加入几滴90%的浓硫酸,捣成糊状,微热并冷却后,先滴入几滴CuSO4溶液,再加入过量的NaOH溶液中和至出现Cu(OH)2沉淀。加热至沸腾,可观察到红色沉淀生成
C.制备硫酸亚铁晶体时,向废铁屑中加入过量稀硫酸,充分反应后,过滤,然后加热蒸干滤液即可得硫酸亚铁晶体
D.测定硫酸铜晶体结晶水含量的实验中,称量操作至少要进行4次
查看答案和解析>>
科目: 来源: 题型:
没有水就没有生命,自然界中的水丰富多样。下面是某中学一研究小组在研究水时所记录的实验现象,请根据已学知识解释。
(1)雷雨天后,一同学取一杯外观浑浊的河水,他在水中加了几颗明矾晶体,搅拌后不一会儿,就变澄清透明,杯底有沉淀物。沉淀物的主要成分是___________,加明矾晶体搅拌后变澄清透明的原因是_________________________________。
(2)某同学家附近有一口老井,井中之水冬天温热、夏天冰凉,清澈无比。他从井中取了一杯清澈的井水到实验室里,加了几滴明矾溶液。结果观察到白色浑浊、少量无色气泡产生等现象。推测这口老井水为什么会有“冬温夏凉”的现象?清澈的井水中加明矾为什么会产生沉淀和气泡?
(3)假期时某同学到一农村的亲戚家去度假,由于那里还没装自来水,日常用水都是从村边的一口井里取来的。有一次他偶然发现,头一天取回的清澈井水表面产生了一层暗红色的“锈皮”,水桶底下还沉积有少量泥沙似的杂质。此后,他天天观察,原来这个现象天天都存在。经过分析他提出了一个假设, 并取样回到学校实验室里进行了验证,证实了自己的假设。请你推测井水中可能含有较多的金属离子是___________,你认为该同学可以用什么方案验证所提出的假设______________________。
查看答案和解析>>
科目: 来源: 题型:
某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如下图装置。
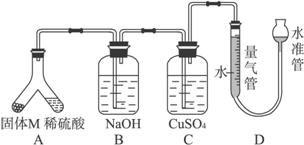
倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化。反应后进入量气管气体的体积为V mL(已折算成标准状况)。
由上述实验事实可知:
(1)①固体M中一定有的物质是__________(填化学式)。理由是_______________________。
②其中一种物质的质量可以确定为____________g(用代数式表示)。
(2)B装置的名称是________________________。
写出B装置中反应的离子方程式___________________________________________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_________________________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是___________。
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥
查看答案和解析>>
科目: 来源: 题型:
实验室中根据2SO2+O2![]() 2SO3;ΔH=-196.6 kJ?mol-1设计如图所示实验装置来制备SO3固体。请完成下列问题:
2SO3;ΔH=-196.6 kJ?mol-1设计如图所示实验装置来制备SO3固体。请完成下列问题:

(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)____________________。
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是______________________________________________________________________。
(3)小试管C的作用是______________________________________________________。
(4)广口瓶D内盛的试剂是__________________________________________________。
装置D的三个作用是:
①_________________________________________________________________;
②_________________________________________________________________;
③_________________________________________________________________。
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是________________________________。
(6)装置F中U形管内收集到的物质的颜色、状态是____________。
(7)装置G的作用是________________________________________。
(8)从G装置导出的尾气处理方法是________________________________________。
查看答案和解析>>
科目: 来源: 题型:
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用图中的装置进行实验。

主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量,得到b g
④从分液漏斗滴入6 mol?L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g
请填空和完成下列问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明 。
(2)装置中干燥管B的作用是 。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填“偏高”“偏低”或“不变”)。
(4)步骤⑤的目的是 。
(5)步骤⑦的目的是 。
(6)该试样中纯碱的质量分数的计算式为 。
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
查看答案和解析>>
科目: 来源: 题型:
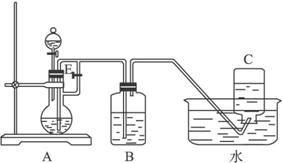
(1)下列实验操作或对实验事实的叙述正确的是________(填序号)。
①向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
②配置100 mL 1.00mol/L的NaCl溶液时,可用托盘天平称取5.85 gNaCl固体;
③向100℃时的NaOH稀溶液中滴加饱和的FeCl3溶液,以制备Fe(OH)3胶体;
④配制氯化铁溶液时,先将氯化铁固体加入盐酸中溶解,然后加水稀释;
⑤分液漏斗分液时,先将下层的液体从下口流出,然后再从下口流出上层的液体
⑥测定某溶液pH时,取一小块干燥的试纸放入玻璃片上,用玻璃棒蘸取溶液滴
在试纸的中部,再与pH试纸比色卡对比(2)在下图所示的实验装置中,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一大烧杯,清回答下列问题:

Ⅰ.实验过程中,观察到的主要现象是:
①铜片表面产生气泡,铜片变小并逐渐消失;
②小烧杯中溶液的颜色逐渐变成绿色;
③________________________________________________。
④________________________________________________。
Ⅱ.用该装置做铜与浓硝酸反应的实验,最突出的优点是______________。
Ⅲ.若要验证最终得到的气体生成物,最简便的方法是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com