
科目: 来源: 题型:
![]() 已知 2SO2+O2 2SO3为放热反应,对该反应的下列说法中正确的是
已知 2SO2+O2 2SO3为放热反应,对该反应的下列说法中正确的是
A.O2的能量一定高于SO2的能量
B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目: 来源: 题型:
生铁中除铁外,还含有碳和硫等其他元素,其中碳元素主要以碳化铁的形态存在,它使生铁性能坚硬而脆,所以生铁的用途不大,一般用做炼钢的原料。某兴趣小组设计按下图所示的实验装置(C的加热装置省略),测定生铁中的碳的质量分数。
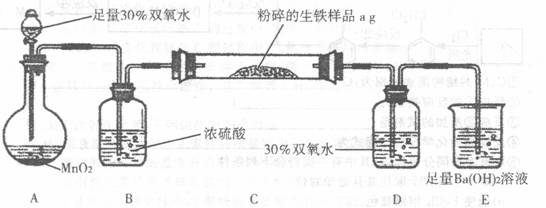
请回答下列问题:
(1)硫在生铁中是有害元素,它使生铁产生热脆性。硫元素在生铁中最有可能存在的价态是___________________
A、-2 B、0 C、+4 D、+6
(2)写出在烧杯E中发生反应的离子方程式:_________________________ ;
(3)D中30%双氧水的作用是_________________________________ ;
若无此装置,所测定的碳的质量分数将__________ (填“偏高”、“偏低”或“不影响”);
(4)反应完成后,欲验证生铁含有硫元素,你所设计的实验方案是(写出实验步骤、现象)
__________________________________________________________________
(5)待C管的样品充分反应后,测得E中生成的沉淀为bg,请计算出生铁中碳的质量分数为_____________________;
(6)实验过程中,该兴趣小组应注意的安全问题是______________。(任写一种)
查看答案和解析>>
科目: 来源: 题型:
锶(Sr)位于元素周期表的第5周期IIA族。碳酸锶(SrCO3)是一种重要的无机产品:被广泛用于彩色电视机的阴极射线管。以天青石和碳酸钠溶液混合浸泡制取碳酸锶的离子方程式是:SrSO4十CO32- SrCO3 +SO42-,△H
请回答下列问题:
(1)下列关于锶及其化合物的叙述中,错误的是___________。
A.锶比钙的金属性强,单质能和水反应放出氢气
B.氢氢化锶呈两性
C.SrCO3难溶于水
D.锶在化合物中呈十2价
(2)当温度升高,上述反应速率增大,但硫酸锶的转化率降低,则说明上述反应的△H__________0 (填“>”、“<”或“==:”)
(3)写出上述反应平衡常数的表达式:K=___________;
若已知Ksp(SrSO4)=3×10-7,Ksp(SrCO3)= 1×10-10,
则该反应的平衡常数的数值是____________;
泉州市质检理综 第10页(共14页)
(4)如果将Na2CO3换成(NH4)2CO3,SrCO3的产率将降低,这与Na2CO3溶液和
(NH4)2CO3溶液的pH有关,当两者浓度、温度均相同时,Na2CO3溶液的pH
____________(填“>”、“<”或“=”)(NH4)2CO3溶液的pH;
(5)另一种以天青石为原料制备碳酸锶的方法是:将天青石粉碎后在1000℃
~1200℃时与碳反应制得可溶性的硫化锶,再由硫化锶经一系列反应制碳酸锶。其中发生的化学反应有:4C(s)+SrSO4(s)=SrS(s) +4CO(g),△H1;SrS(s)+2O2(g)=SrSO4(s),△H2;2C(s)+O2(g) == 2CO(g),△H3;已知:
△H2 = akJ?mol-1。;△H 3 = b kJ?mol-1
则△H1__________(用含a和b的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下图所示:
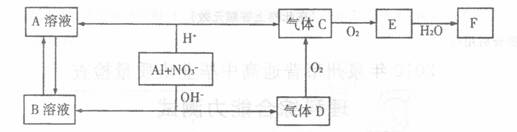
其中,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)写出Al3+的结构示意图 __________________ ;
(2)在下列离子方程式的横线上填写产物的化学式(不需要配平)
Al + NO3- + OH- + H2O ――→_________________ + _______________
(3)将A转化为B,可加入的试剂是_______________________;
(4)写出D――→C反应的化学方程式:
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质是___________________;
(6)写出气体D的一种用途___________________________________________;
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是_____。
查看答案和解析>>
科目: 来源: 题型:
右图中,两电极上发生的电极反应分别为: a极:Ag+ +e = Ag
b极:Fe一2e= Fe2+
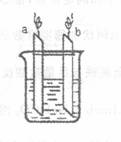
下列说法不正确的是
A.a、b可能是同种电极材料
B.该装置一定是电解池
C.装置中电解质溶液一定含有Ag+
D.装置中发生的反应方程式一定是Fe + 2Ag+ === Fe2+ +2Ag
查看答案和解析>>
科目: 来源: 题型:
下列各选项所描述的两个量中,前者一定大于后者的是
A.pH=3的盐酸的c(Cl-)和pH=3的醋酸溶液的c(CH3COO-)
B.pH相同的氨水和醋酸钠溶液中,由水电离产生的c(H+)
C。0.1mol/L的盐酸和0.1mol/L的醋酸分别与金属镁反应的起始速率
D.pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH
查看答案和解析>>
科目: 来源: 题型:
下表所列各组第Ⅰ栏中的化学反应与第Ⅱ栏中的化学反应,都可以用第Ⅲ栏中的离子方程式表示的是
| 选项 | 第Ⅰ栏 | 第v栏 | 第Ⅲ栏 |
| A | 往少量NaOH溶液中 投入铝片 | 往过量NaOH溶液中 投入铝片 | Al +4OH- == [Al(OH)4]-十3H2↑ |
| B | 往Fe2(SO4)3溶液中 滴入氢氧化钠溶液 | 往Fe2(SO4)3溶液中 滴入氢氧化钡溶液 | Fe3+ +3OH- == Fe (OH)3↓ |
| C | 往NaHCO3溶液滴入Ca(OH)2溶液 | 往NaHCO3溶液滴入 NaOH溶液 | OH- +HCO3- == CO32- +H2O |
| D | 往NaOH溶液中 通入过量CO2气体 | 往NaOH溶液中 通入少量CO2气体 | CO2 +OH- == HCO3- |
查看答案和解析>>
科目: 来源: 题型:
若NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6g金属铁与足量盐酸反应时,失去0.3NA个电子
B.100mL 1mol/L NaHCO3溶液含有0.1NA个CO32-
C.常温常压下,1mol氦气含有2NA个原子
D.20g重水(2H2O)含有10NA个电子
查看答案和解析>>
科目: 来源: 题型:
下列实验操作正确的是
A。用洁净的玻璃棒蘸取试液,点在湿润的pH试纸上测定试液的pH
B.将称量好的固体直接加入容量瓶中,加水溶解并稀释至刻度,配制
成一定物质的量浓度的溶液
C.欲从碘水中分离出I2,可将适量的CCl4加入碘水中振荡静置分层后分液
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com