
科目: 来源: 题型:
固体氧化物燃料电池是以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O 2-)在其间通过,该电池的工作原理如下图所示,其中多孔电极a\,b均不参与电极反应。下列判断正确的是
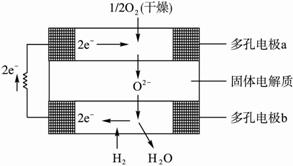
A. 有O2参加反应的a极为电池的负极
B. b极的电极反应为:H2-2e -+O 2-H2O
C. a极的电极反应为:O2+2H2O+4e -4OH -
D. 该电池的总反应式为:2H2+O2![]() 2H2O
2H2O
查看答案和解析>>
科目: 来源: 题型:
2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为:
①2MoS2+7O2![]() 2MoO3+4SO2;
2MoO3+4SO2;
②MoO3+2NH3![]() H2O(NH4)2MoO4+H2O;
H2O(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HClH2MoO4↓+2NH4Cl;
④H2MoO4![]() MoO3+H2O;
MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
A.MoS2燃烧产生的尾气可直接排空
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目: 来源: 题型:
将分别盛有熔融KCl、MgCl2、Al2O3的三个电解池串联,在一定条件下通电一段时间后,析出的K、Mg、Al的物质的量之比为( )
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
查看答案和解析>>
科目: 来源: 题型:
某500 mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)( )
A.0.4 mol?L-1 B.0.6 mol?L-1 C.0.8 mol?L-1 D.1.0 mol?L-1
查看答案和解析>>
科目: 来源: 题型:
镁比铝元素的金属性强,以下说法不能说明这一点的是( )
A.氢氧化镁是中强碱而氢氧化铝具有两性
B.铝在冷的浓硫酸中钝化而镁不钝化
C.氯化镁的熔点比氯化铝的熔点高
D.镁能与沸水发生置换反应而铝不能
查看答案和解析>>
科目: 来源: 题型:
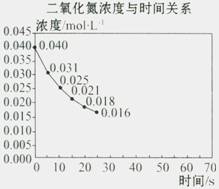 二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45 s时,达到平衡(NO2浓度约为0.0125 mol/L)。右图中的曲线表示二氧化氮分解反应在前25 s内的反应进程。
二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45 s时,达到平衡(NO2浓度约为0.0125 mol/L)。右图中的曲线表示二氧化氮分解反应在前25 s内的反应进程。
(1)请计算前20 s内氧气的平均生成速率:
(2)若反应延续至70 s,请在图中用实线画出25 s~70 s的反应进程曲线。
(3)若在反应开始时加入催化剂(其他条件不变),请在图上用虚线画出加入催化剂后的反应进程曲线。
查看答案和解析>>
科目: 来源: 题型:
下列各项反应速度的差异,分别与哪个因素的关系最密切?
(1)硫在O2中比在空气中燃烧剧烈: ;
(2)卤化银要保存在棕色试剂瓶中 ;
(3)MnO2加入双氧化水中反应更剧烈 ;
(4)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完 ;
(5)镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生 。
查看答案和解析>>
科目: 来源: 题型:
市场上出售的“热敷袋”其中的成分主要是铁粉、炭粉、木屑和少量氯化钠、水等。热敷袋用塑料袋密封,使用时从袋中取出轻轻揉搓就会放出热量,用完后袋内有大量铁锈生成,回答下列各问题:
(1)热敷袋放出的热是由于 。
(2)炭粉和氯化钠的作用分别是 。
(3)写出有关的电极反应式和化学方程式:
;
;
。
查看答案和解析>>
科目: 来源: 题型:
向体积为2 L的容器中加入1 mol N2和6 mol H2进行可逆反应:
![]() ,2 min后测得N2的物质的量为0.6 mol,则:
,2 min后测得N2的物质的量为0.6 mol,则:
(1)2 min内,N2的物质的量减少了0.4 mol,H2的物质的量减少了 ,NH3的物质的量增加了 ;
(2)若用N2的浓度变化来表示该反应的反应速率,即V(N2)= ;
(3)若用H2的浓度变化来表示该反应的反应速率,即V(H2)= ;
(4)若用NH3的浓度变化来表示该反应的反应速率,则V(NH3)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com