
科目: 来源: 题型:
在复杂的体系中,研究化学反应的先后顺序有利于解决问题。下列物质或微粒参与反应先后顺序判断正确的是
A.含有等物质的量的![]() 的溶液中逐滴加入盐酸:
的溶液中逐滴加入盐酸:![]() ,
,
![]()
B.含有等物质的量的FeBr2和Fel2溶液中缓缓通入![]()
C.在等物质的量的K2CO3和KOH混合溶液中缓缓通入CO2:K2CO3,KOH
D.在含有等物质的量的![]() ,
,![]() 的溶液中逐渐加入锌粉:
的溶液中逐渐加入锌粉:![]()
查看答案和解析>>
科目: 来源: 题型:
下列实验中,金属或同体可以完全溶解的是
A.在H2O2溶液中加入少量MnO2粉末
B.表面已经被氧化的铝片加入到足量的NaOH溶液中
C.1molMnO2和含4molHCl的盐酸共热
D.常温下1mol铁片投入含4molHNO3的浓硝酸中
查看答案和解析>>
科目: 来源: 题型:
MnO2和Zn是制造于电池的重要原料,工业上用软锰矿联合生产MnO2和Zn的基本步骤为:
(1)软锰矿、闪锌矿与硫酸共热:![]()
(2)除去反应混合物中的不溶物
(3)电解混合物:![]()
下列说法错误的是
A.步骤(1)中MnO2和H2SO4都是氧化剂
B.步骤(1)中每析出12.8gS沉淀共转移0.8mol电子
C.电解时MnO2在阳极处产生
D.硫酸在生产:中可循环使用
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是
A.同主族元素从上到下,元素原子得电子能力逐渐减弱,表现在氢化物的稳定性逐渐减弱,熔沸点逐渐升高
B.除稀有气体元素外,第三周期元素的原子半径不一定比第二周期元素的原子半径大
C.化合反应都是放热反应,分解反应都是吸热反应。因此化合反应都形成新化学键,分解反应都破坏旧化学键
D.在主族元素中,最外层电子数少的元素原于一定比最外层电子数多的元素原子失电子能力强
查看答案和解析>>
科目: 来源: 题型:
我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。PETG的结构简式如下:
这种材料可采用如下图所示的合成路线
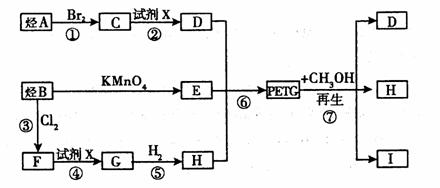 |
![]() (1)
(1)
(2)RCOORl+R2OH→RCOOR2+R1OH(R、R1、R2表示烃基)
试回答下列问题:
(1)⑦的反应类型是 。
(2)写出I的结构简式: 。
(3)合成时应控制的单体的物质的量:n(H)∶n(E)∶n (D)= (用m、n表示)。
(4)写出反应②的化学方程式:
(5)写出同时符合下列两项要求的E的所有同分异构体的结构简式。
①该同分异构体的苯环上相邻的三个碳原子上都连有取代基。
②该同分异构体在一定条件下能发生银镜反应和水解反应,遇到FeCl3溶液显紫色。
、 、 。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
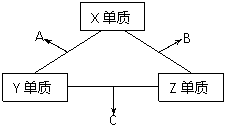 |
已知一个B分子中含有的Z元素的原子个数比C分子少1个。
请回答下列问题:
⑴X元素在周期表中的位置是 。
⑵X单质与Z单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多
孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入 (填名称);负极电极反应式为 。
⑶C在一定条件下反应生成A的化学方程式是 。
⑷X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH 7(填“大于”、“小于”或“等于”),其原因是(用离子方程式表示): 。
⑸已知Y单质与Z单质生成C的反应是可逆反应,ΔH<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中正确的是 。(填写字母编号)
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中,气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
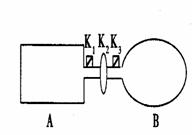 A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2 ![]() N2O4;△H<0)
N2O4;△H<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_________VB (填“>”、“<”、“=”);若打开活塞K2,气球B将__________(填:变大、变小、不变)。
(2)若在A、B中再充人与初始量相等的NO2,则达到平衡时,NO2的转化率αA将_________ (填增大或减小、不变);若通人等量的Ne气,则达到平衡时,A中NO2的转化率将_________,B中NO2的转化率将_________(填:变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_________中的颜色较深。
(4)若在容器A中充人4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为_________。
查看答案和解析>>
科目: 来源: 题型:
下图中A、B、C分别是某课外活动小组设计的制取氨气并进行喷泉实验的三组装置示意图,制取NH3选用试剂如图所示,回答下列问题:
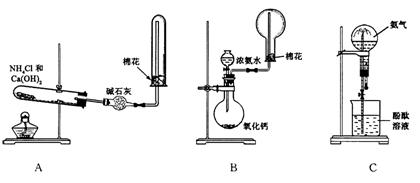 |
(1)用A图所示的装置可制备干燥的NH3:
①反应的化学方程式为:__________。装置中收集NH3的试管口放置棉花团的作用是:_____ ____。
②干燥管中干燥剂能否改用无水CaCl2___________,理由是_________________________.
(2)用B图所示的装置可快速制取较大量NH3拟作喷泉实验。根据B图所示的装置及试剂回答下列问题:
①用化学方程式表示:浓氨水滴人CaO中有大量NH3逸出的过程:___________________.
②检验NH3是否收集满的实验方法是:________________________________。
查看答案和解析>>
科目: 来源: 题型:
25℃时,在20 mL 0.1 mol?L-1 NaOH溶液中逐滴加入0.2 mol?L-1 醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中不正确的是( )
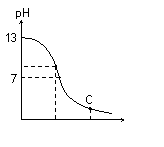
A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com