
科目: 来源: 题型:
一定温度下,甲乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲乙两瓶氨水中c(OH―)之比为( )
A. 大于10 B. 小于10 C. 等于10 D. 无法确定
查看答案和解析>>
科目: 来源: 题型:
0.1 mol/L的CH3COOH溶液达到电离平衡时( )
A. c(CH3COO― ) = c( H+ ) B. c(CH3COOH) = 0.1mol/L
C. c(CH3COOH) < c(CH3COO― ) D. c(H+) = c(OH― )
查看答案和解析>>
科目: 来源: 题型:
证明氨水是弱碱的事实是( )
A.氨水与硫酸发生中和反应 B.氨水能使紫色石蕊液变蓝
C.0.1 mol/L的NH4Cl溶液的pH值为5.1 D.铵盐与熟石灰反应逸出氨气
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.强电解质一定是离子化合物 B.强电解质、弱电解质的电离都是吸热过程
C.强电解质的饱和溶液一定是浓溶液 D.强电解质在水中一定能全部溶解
查看答案和解析>>
科目: 来源: 题型:
与有机物B相关的反应信息如下:
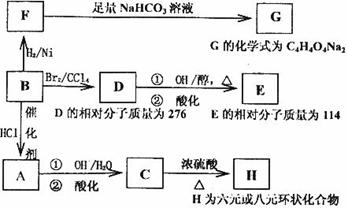
(1)写出下列反应的反应类型:
B→A______________,D→E第①步反应________________。
(2)写出E、C的结构简式:E_______________。C_______________。
(3)C的一种同分异构体K有如下特点:1molK可以和3mol金属钠发生反应放出33.6LH2(标准状况下),1molK可以和足量的NaHCO3溶液反应,生成1molCO2,1molK还可以发生银镜反应生成2moIAg,试写出K的结构简式________________________。
(4)写出在浓硫酸存在并加热的条件下,F与足量乙醇反应的化学方程式
________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
为 探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组设计了如下图
所示的实验装置。
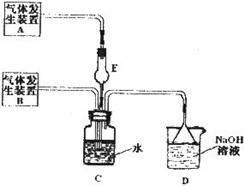
试填空。
(1)请你预测C12、SO2同时通入H2O中恰好发生反应后的产物(填写离子)_________。
设计简单的实验验证其中一种阴离子的存在____________________
(2)化学兴趣小组的同学为制取![]() 、
、![]() 气体,现采用NA2SO3与70%的浓硫酸为原
气体,现采用NA2SO3与70%的浓硫酸为原
料制取SO2,采用MnO2和浓盐酸为原料制取C12。在此实验中,E仪器的作用是__________;发生装置B应选择以下三种装置中的___________(填序号)。

(3)上述整套装置有一处不合理,应在_________装置之间(填代号)连接一装置,请在答题纸的方框中画出简易装置图,并注明装置中盛有的试剂。
(4)下列试剂中的一种就可以验证通入C装置中气体是Cl2过量还是SO2过量,该试剂是_________,实验现象及结论为_____________________________________________________
______________________________________。
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④碘化钾溶液
⑤品红溶液 ⑥酸性高锰酸钾溶液 ⑦液体四氯化碳
查看答案和解析>>
科目: 来源: 题型:
工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。
(1)该工艺的中间过程会发生反应:![]() ,反应的氧化剂是_____________________。
,反应的氧化剂是_____________________。
(2)尾气中的SO2经处理可得到有价值的化学品,写出其中1种酸和1种盐的名称
____________________________。
(3)黄铜矿熔炼后得到的粗铜含少量Fe、Zn、Ag、Au等金属杂质,需进一步采用电解法精制。在精炼铜时,阳极材料是________,阴极电极反应式是_____________________。
(4)在精炼铜的过程中,电解液中![]() 逐渐下降,
逐渐下降,![]() 、
、![]() 会逐渐增人,所以需定时除去其中的
会逐渐增人,所以需定时除去其中的![]() 、
、![]() 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。
| 物质 |
|
|
|
|
| 溶度积 |
|
|
|
|
甲同学设计了如下除杂方案:
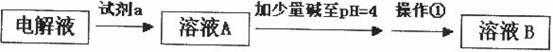
试剂a是__________,其目的是____________________________________;根据溶度积该方
案能够除去的杂质金属阳离子是____________。
乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水
调节pH至7~8,可使![]() 生成
生成![]() 。沉淀而除去。”乙同学认为甲同学的方案中也
。沉淀而除去。”乙同学认为甲同学的方案中也
应该将溶液pH调至7~8。你认为乙同学的建议是否正确?________(填“是”或“否”),
理由是___________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
铝士矿(主要成分为![]() 、
、![]() 、
、![]() )是提取氧化铝的原料.提取氧化铝的
)是提取氧化铝的原料.提取氧化铝的
工艺流程如下:
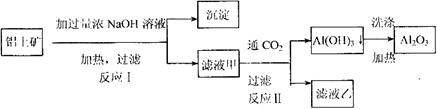
(1)写出反应Ⅱ的离子方程式_________________________________________________
(2)已知滤液乙的成分除![]() 外还含有
外还含有![]() 、
、![]() 中的一种或两种,所含物质的质量分数都在5%以上。请设计合理实验探究该滤液乙中
中的一种或两种,所含物质的质量分数都在5%以上。请设计合理实验探究该滤液乙中![]() 、
、![]() 的存在。仅限选择的仪器和试剂:烧杯、试管、带导管的橡皮塞、玻璃棒、蒸发皿、泥三角、三脚架、铁架台、酒精灯、过滤器、洗气瓶、滴管、药匙;lmol?L
的存在。仅限选择的仪器和试剂:烧杯、试管、带导管的橡皮塞、玻璃棒、蒸发皿、泥三角、三脚架、铁架台、酒精灯、过滤器、洗气瓶、滴管、药匙;lmol?L![]() 盐酸、2mol?L
盐酸、2mol?L![]() MgCl2溶液、澄清饱和石灰水。
MgCl2溶液、澄清饱和石灰水。
完成以下实验探究过程:
①提出假设:
假设1:滤液乙中除![]() 外还含有__________________;
外还含有__________________;
假设2:滤液乙中除![]() 外还含有_________________;
外还含有_________________;
假设3:滤液乙中除![]() 外还含有
外还含有![]() 、
、![]() ;
;
②设计实验方案:基于假设3,设计出实验方案(筒述实验操作、预期现象和结论)。
___________________________________________________________________________
__________________________________________________________________________。
(3)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为_____________________________________________________________
 (4)取(3)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol?L
(4)取(3)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol?L![]() 盐酸溶液,当加入50.0mL盐酸溶液时,生成的沉淀恰好溶解。
盐酸溶液,当加入50.0mL盐酸溶液时,生成的沉淀恰好溶解。
①加入50.0mL盐酸溶液发生
的离子反应按先后顺序依次为
__________________________
__________________________。
②请画出生成沉淀的物质的量
与加入盐酸体积的关系图。
查看答案和解析>>
科目: 来源: 题型:
向2L密闭容器中充入2molSO2和一定量的O2,发生如下反应:![]() 。
。
当反应进行到4min时,测知SO2为0.4mol,当反应进行到2min时,密闭容器中SO2物质的量为
A.等于1.2mol B.小于1.2mol C.大于1.2mol D.无法判断
查看答案和解析>>
科目: 来源: 题型:
下述实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 将 | 配制质量分数为10%的 |
| B | 向盛有1mL硝酸银溶液的试管中滴加KI溶液,至不再有沉淀,再向其中滴加 | 说明一种沉淀能转化为溶解度更小的沉淀 |
| C | 在298K时,分别向2支试管中加入相同体积、相同浓度的HI溶液,再分别加入相同体积不同浓度的H2O2溶液 | 研究浓度对反应速率的影响 |
| D | 室温下,测定浓度为 | 比较HClO和CH3COOH的酸性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com