
科目: 来源: 题型:
下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
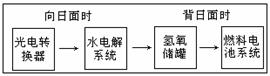
A.该能量转化系统中的水也是可能循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极反应:4OH-![]() 2H2O+O2↑+4e -
2H2O+O2↑+4e -
D.燃料电池放电时的负极反应:H2+2OH-![]() 2H2O+2e -
2H2O+2e -
查看答案和解析>>
科目: 来源: 题型:
用两支惰性电极插入500mL AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(电解时阴极没有氢气放出,且电解液在前后体积变化可以忽略),电极上析出的质量大约是( )
A. 27mg B. 54 mg C. 108 mg D. 216 mg
查看答案和解析>>
科目: 来源: 题型:
用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,该电池放电时的总反应为:CH4+2KOH+2O2==K2CO3+3H2O,下列说法错误的是( )
A. 通甲烷的一极为负极,通氧气的一极为正极
B. 放电时通入氧气的一极附近溶液的pH升高
C. 放电一段时间后,KOH的物质的量不发生变化
D. 通甲烷的电极反应式是:CH4+10OH --8e-==CO32-+7H2O
查看答案和解析>>
科目: 来源: 题型:
用惰性电极电解100mL饱和食盐水,一段时间后,在阴极得到112mL H2(标准状况),此时电解质溶液(体积变化忽略不计)的pH为 ( )
A. 13 B. 12 C. 8 D. 1
查看答案和解析>>
科目: 来源: 题型:
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl - -2e -==Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH -
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- == Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e - == Fe2+
查看答案和解析>>
科目: 来源: 题型:
生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示。已知C1极的电极反应方程式为:C2H5OH+3H2O-12e-=2CO2+12H+。下列说法不正确的是
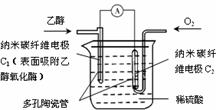
A.C1极为电池负极,C2极为电池正极
B.C2极的电极反应式为O2+4H++4e-=2H2O
C.该生物燃料电池的总反应方程式为
C2H5OH+3O2=2CO2+3H2O
D.电子由C2极经外电路导线流向C1极
查看答案和解析>>
科目: 来源: 题型:
下列各变化中属于原电池反应的是( )
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓硝酸比稀硝酸更能氧化金属铜
查看答案和解析>>
科目: 来源: 题型:
可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),该可逆反应在10L的密闭容器中进行,30秒后,水蒸气的物质的量增加了0.45mol,请分别用NH3 、O2、NO、H2O表示该可逆反应的化学反应速率?
4NO(g)+6H2O(g),该可逆反应在10L的密闭容器中进行,30秒后,水蒸气的物质的量增加了0.45mol,请分别用NH3 、O2、NO、H2O表示该可逆反应的化学反应速率?
查看答案和解析>>
科目: 来源: 题型:
温度、固体表面积、反应物状态、溶液浓度、催化剂等都是影响化学反应速率的重要因素。这种影响化学反应速率的因素在我们日常生活、工农业生产及化学实验中被广泛采用。对我们有利的化学反应,需要想办法增大反应速率以提高生产和工作效率;对我们不利的化学反应,需要设法降低反应速率,以减少这些反应对我们的危害。试从增大反应速率和降低反应速率两方面举出在控制化学反应条件的例子。填写下表:
| 控制条件 | 增大反应速率的例子 | 降低反应速率的例子 |
| 温度 | ① | ② |
| 固体表面积 | ③ | ④ |
| 反应物状态 | ⑤ | ⑥ |
| 溶液浓度 | ⑦ | ⑧ |
| 催化剂 | ⑨ | ⑩ |
查看答案和解析>>
科目: 来源: 题型:
将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是 ( )
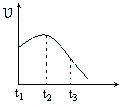 A.从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高
A.从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的原因是镁与水反应,致使酸的浓度升高
C.从t2→t3的原因是随着反应的进行酸的浓度下降
D.从t2→t3的原因是随着反应的进行温度越来越低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com