
科目: 来源: 题型:
下图中X(C7H6O2)与FeCl3溶液作用显紫色,可用于合成香料Y
E、F、G三种物质分子中含有相同的碳原子数,其中E、F均能与银氨溶液作用。
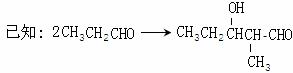
 |
请根据上述信息回答:
(1)A物质的化学式为_________,D中含氧官能团的名称是__________。
(2)E→F的反应类型为___________,F→G的反应类型为___________。
(3)写出X的能使FeCl3溶液显紫色的同分异构体的结构简式___________、__________。
(4)G在浓硫酸存在的条件下加热反应生成Y的化学方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
N和B元素在化学中有很重要的地位。k.s.5.u
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_____________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为____________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其原因是_____________________________________________,其中BF3的分子构型为__________。
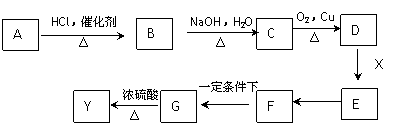
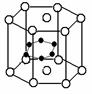 (3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(4)硼和镁的化合物在超导方面也有应用。右图示意的是该化合物的晶体结构单元;镁原子间形成正六棱柱,且棱柱的上下底的中心各有一个镁原子;六个硼原子位于棱柱内,则该化合物的化学式可表示为______________。
查看答案和解析>>
科目: 来源: 题型:
.5.u
将某工业生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,在经济效益、资源综合利用以及环境保护角度都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
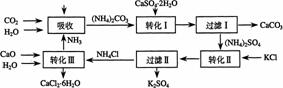
(1)本工艺中所用的原料除CaSO4·2H2O外,还需要的原料有____________(填字母)。
①(NH4)2SO4 ②KCl ③CaCO3 ④NH3 ⑤H2O
(2)过滤Ⅰ操作所得固体中,除CaCO3外还含有__________(填化学式),该固体可用作生产水泥的原料。
(3)写出转化Ⅲ发生反应的化学方程式_______________________________________。
(4)上述工艺流程中体现绿色化学理念的有____________________________________。
查看答案和解析>>
科目: 来源: 题型:
白云石的主要成分为CaCO3·MgCO3,还含有少量Fe、Si的化合物。实验室以白云石为原料制备Mg(OH)2及CaCO3。步骤如下:

实验过程中需要的数据见下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Mg2+ | 9.5 | 11.0 |
请回答下列问题:
(1)溶液A中含有Ca2+、Mg2+、Fe2+、Fe3+,则试剂①可选择_________(填字母,下同);试剂②可选择_________;试剂③可选择_________。
(A)KMnO4(B)Cl2(C)MgO(D)CaO
(2)若要利用反应过程中生成的CO2,从溶液D中制取CaCO3,需要先通入的一种气体是_______,然后通入CO2。通入CO2气体应选择的最佳装置为_______(填字母)。

(3)根据表中提供的数据判断,Fe(OH)3、Fe(OH)2和Mg(OH)2的溶度积常数由小到大的排列顺序为________________________________。
(4)将制取的Mg(OH)2煅烧得到MgO,然后在还原炉(真空)中,1200℃条件下,用硅铁(铁不参与反应)还原生成镁蒸气。在还原过程中反应温度对生成金属镁的影响如下图:

煅烧Mg(OH)2所需要的仪器除三角架、酒精灯外,还必须选择___________。MgO与硅铁发生的反应达到平衡后,平衡常数表达式为_______________________。由图可知,还原反应的△H ____0(填“>”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
过氧化氢是一种重要的化工原料,它具有氧化性、还原性、不稳定性和弱酸性。
(1)废旧印刷电路板经粉碎处理,分离得到金属粉末和非金属粉末。控制其他条件相同,将金属粉末用10% H2O2和3.0mol·L-1 H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜的平均溶解速率 (×10-3mol·L-1 ·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是________________________________________________________________。
(2)在酸性条件下,过氧化氢可以氧化Fe2+;过氧化氢也可以被Fe3+氧化。通过改变反应途径,Fe2+和H+实际对H2O2的分解起着催化剂的作用。试用离子方程式表示Fe2+和H+对H2O2分解反应的催化过程________________________________;__________________________。
(3)下列试剂能够证明过氧化氢具有还原性的是________________(填序号)。
①酸性高锰酸钾溶液 ②KI溶液 ③亚硫酸溶液 ④Ba(OH)2溶液
(4)将H2O2溶液逐滴加入含有酚酞的NaOH溶液中,红色消失。甲同学认为是由于H2O2是弱酸性,消耗OH-,而使红色褪去;乙同学认为是由于H2O2具有强氧化性,将酚酞氧化,而使红色褪去。请设计一个实验验证甲、乙同学的解释谁正确,简述实验方案_______________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是_________(填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源k.s.5.u
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出84消毒液露置在空气中发生反应的离子方程式__________________________
__________________________。
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。
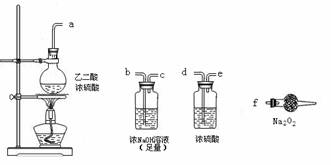
已知:H2C2O4 CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为________;
若CO能够与Na2O2发生反应,则预测反应产物为____________。实验后用球形干燥管中的固体进行验证可选择的试剂是_______________________________。
(4)已知C(s)+O2(g)=CO2(g),△H=-393.5 kJ·mol -1 ;CO(g)+![]() O2(g)=CO2(g),△H=-283.0 kJ·mol -1,写出CO2 和C(s)反应的热化学方程式_____________________________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
O2(g)=CO2(g),△H=-283.0 kJ·mol -1,写出CO2 和C(s)反应的热化学方程式_____________________________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
查看答案和解析>>
科目: 来源: 题型:
下列叙述错误的是
A. 钢铁表面发生吸氧腐蚀时,钢铁表面水膜的pH增大
B. 电解精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量少
C. 在镀件上电镀锌,可以用锌作阳极,也可以用惰性电极材料作阳极
D. 工作时在原电池的负极和电解池的阴极上都是发生失电子过程
查看答案和解析>>
科目: 来源: 题型:
在容积不变的密闭容器中,一定条件下发生反应:2A![]() B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是( )
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是( )
A.升高温度,正反应速率增大,逆反应速率减小
B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应
D.若向容器中充入惰性气体,则平衡向右移动
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是
A.Cl2和SO2的漂白原理不同,混合使用效果更好
B.金属Na投入到CuSO4溶液中能置换出金属Cu
C.FeCl2和Fe(OH)3都不能通过化合反应直接制取
D.相同浓度的Na2CO3和NaHCO3溶液可以用稀盐酸鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com